دوبامين
الدوبامين [ملاحظة 1] مادّة عضوية تصنّف كيميائياً ضمن الكاتيكولامينات والفينئيثيلامينات. تُفرَز هذه المادّة في جسم الإنسان، وتلعب دور هرمون وناقل عصبي، ولها تأثيرات عديدة على الدماغ بشكلٍ خاصّ، وعلى جسم الإنسان بشكلٍ عامّ. يحتوي الدوبامين بنيوياً على مجموعة أمين، وهو يُصطنَع حيوياً من عملية نزع مجموعة كربوكسيل من سلفه المركّب الطليعي L-دوبا وذلك في الدماغ والكليتين. يُصطنَع هذا المركّب أيضاً في الكائنات الحيّة الأخرى مثل النباتات وأغلب الحيوانات. تقوم الخلايا العصبية في الدماغ بإفراز الدوبامين، وذلك ضمن مسارات دوبامينية عديدة ومميّزة، يلعب إحداها دوراً محورياً أساسياً في العامل التحفيزي في نظام المكافأة في الدماغ، إذ أنّ توقّع المكافآت يزيد من مستويات الدوبامين في الدماغ؛ ومن جهة أخرى، تقوم العقاقير نفسانية التأثير والمسبّبة للإدمان إمّا بزيادة إفراز الدوبامين أو بالعمل على حجب استرداد الخلايا العصبية لهذه المادّة بعد إفرازها. تساهم المسارات الدوبامينية -أيضاً- في التأثير على الجهاز الحركي، وفي التحكّم بإفراز هرمونات أخرى. تشكّل هذه المسارات مع مجموعةٍ خاصّة من العصبونات نظاماً محدّداً (نظام دوباميني) له القدرة على التعديل العصبي.
| دوبامين | |
|---|---|
| تداخل دوائي | |
| يعالج | |
| اعتبارات علاجية | |
| بيانات دوائية | |
| استقلاب (أيض) الدواء | MAO، COMT[2] |
| بيانات فيزيولوجية | |
| النسيج الحيوي المصدري | المادة السوداء، المنطقة السقيفية البطنية، وغيرها |
| النسيج الحيوي المستهدف | كامل الأجهزة |
| المستقبلات | مستقبلات الدوبامين من الأنماط وD5، بالإضافة إلى المستقبلات المرتبطة بالأمين النزر 1 [2] |
| الناهضات | بشكل مباشر: آبومورفين، بروموكريبتين بشكل غير مباشر: كوكايين، أمفيتامين |
| المناهضات (الضادّات) | مضادات الذهان، ميتوكلوبراميد، دومبيريدون |
| المركب الطليعي (السلف) | فينيل ألانين، تيروسين، ليفودوبا (L-DOPA) |
| الاصطناع الحيوي | نازعة كربوكسيل دوبا |
| الاستقلاب (الأيض) | MAO، COMT[2] |
| معرّفات | |
| CAS | 51-61-6 |
| ك ع ت | C01CA04 |
| بوب كيم | 681[3] |
| ECHA InfoCard ID | 100.000.101 |
| درغ بنك | DB00988 |
| كيم سبايدر | 661[4] |
| المكون الفريد | VTD58H1Z2X |
| كيوتو | D07870[5]، وC03758 |
| ChEMBL | CHEMBL59[6] |
| بيانات كيميائية | |
| الصيغة الكيميائية | C₈H₁₁NO₂[3] |
| نقطة الانصهار | 128 درجة حرارة مئوية |
| تعديل مصدري - تعديل | |
يُعرَف الدوبامين بين العوام وفي وسائل الإعلام المختلفة باسم «هرمون السعادة»؛ رغم أنّ دوره وفق علم الأدوية قائمٌ على إضفاء تميّز تحفيزي؛[7][8][9] بمعنى آخر، فإنّ الدوبامين يُفرَز عند إدراك بروز الأهمّية التحفيزية (مثل الرغبة) لنتيجةٍ معيّنة، ممّا يؤدّي إلى دفع سلوك الكائن الحيّ تجاه تحقيق تلك النتيجة.[9][10]
يقوم الدوبامين خارج الجهاز العصبي المركزي بشكلٍ رئيسي في التأشير نظير الصمّاوي (أي أنّ له تأثير موضعي على إفراز الهرمونات الأخرى بالقرب من الغدد الصمّ حيث يُصطنَع بجوارها)؛ ففي الأوعية الدموية يقوم الدوبامين بتثبيط إفراز نورإبينفرين ويؤدّي دور موسّع وعائي (بتراكيز طبيعية)؛ وفي الكليتين يزيد من طرح الصوديوم والبول؛ وفي البنكرياس يقلّل من إنتاج الإنسولين؛ وفي الجهاز الهضمي يقلّل من قابلية الحركة في الأمعاء ويحمي الأغشية المخاطية فيها؛ وفي الجهاز المناعي يقلّل من نشاط الخلايا اللمفاوية.
يترافق نقص الدوبامين أو حدوث خلل في النظام الدوباميني مع حدوث عددٍ من أمراض الجهاز العصبي، كما أنّ هناك عددٌ من الأدوية المستخدمة في علاج تلك الأمراض والتي يقوم عملها على تغيير آثار الدوبامين. فعلى سبيل المثال، تحدث الإصابة بمرض باركنسون جرّاء فقدان الخلايا العصبية المفرزة للدوبامين في منطقة المادّة السوداء داخل الدماغ المتوسّط. لعلاج ذلك المرض تُستخدَم مادّة ليفودوبا، وهي المركّب الطليعي الذي يسبق الدوبامين في اصطناعه الحيوي داخل الجسم، وذلك ما يمكّن من تعويض العوز الحاصل. من الأمراض الأخرى المرتبطة بنقص نشاط الدوبامين كلّ من متلازمة تململ الساقين واضطراب نقص الانتباه مع فرط النشاط.[11] من جهة أخرى، تشير دلائل على تغيّر مستويات نشاط الدوبامين في مرض الفصام؛ بحيث أنّ أغلب مضادّات الذهان المستخدمة في علاجه هي من مضادات الدوبامين، والتي تعمل على التقليل من نشاط هذه المادّة.[12] بشكلٍ مشابه، تُستخدَم عقاقير مضادّة للدوبامين في مضادّات القيء. يُستخدَم الدوبامين عقاراً بحدّ ذاته حيث يُعطى وريدياً؛ من جهة أخرى يمكن أن تكون العقاقير محاكية الودّي الدوبامينية مسبّبة للإدمان عند أخذها بجرعات كبيرة.
البنية
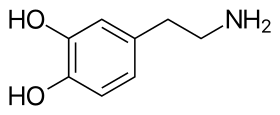
عدليتألّف جزيء الدوبامين من بنية كاتيكول (وهي بدورها مؤلّفة من حلقة بنزينية مُستَبدلة بمجموعتي هيدروكسيل متجاورتين)، وهي مرتبطة بمجموعة أمينية عبر سلسلة من الإيثيل.[13] بالتالي، فإنّ الدوبامين هو أبسط الكاتيكولامينات، وهي عائلة من المركّبات تتضمّن أيضاً كل من النواقل العصبية: نورإبينفرين وإبينفرين (أدرينالين).[14] يؤدّي اتصال المجموعة الأمينية مع الحلقة البنزينية إلى تصنيف الدوبامين ضمن الفينيثيلامينات (مركّبات فينيثيلامين مستبدلة؛ تقرأ مجزأة على الشكل فين إيثيل أمين)، وهي مركّبات نفسانية التأثير.[15]
كما هو الحال مع أغلب الأمينات، فإنّ الدوبامين هو قاعدة عضوية؛[16] ولذلك فإنّه يسهل برتنة هذا المركّب في الأوساط الحمضية بتفاعل حمض-قاعدة نمطي. يتّسم الشكل المُبَرْتَن من الدوبامين بانحلاليته المرتفعة في الماء وباستقراره؛ ولكن يمكن أكسدته عند تعريضه للأكسجين أو لأحد المؤكسدات الأخرى. أمّا في الأوساط القاعدية، فلا يمكن برتنة الدوبامين؛ وفي شكل القاعدة الحرّة تلك يكون الدوبامين أقلّ انحلالية في الماء، كما يكون نشاطه الكيميائي كبيراً جداً. ولهذا السبب فإنّ الدوبامين غالباً ما يكون مثبّتاً على شكل ملح هيدروكلوريد، والذي يكون في حالته الجافّة على شكل مسحوق ناعم أبيض اللون.
الكيمياء الحيوية
عدلالاصطناع الحيوي
عدليُصطنَع الدوبامين حيوياً داخل جسم الإنسان وفق مساراتٍ محدّدة ومن نوعية محدّدة من الخلايا، وبشكلٍ أساسي من العصبونات والخلايا في لب الغدة الكظرية. هناك مسارٌ رئيسي للاصطناع ومسارَين ثانويّيَن:
- رئيسي: L-فينيل ألانين ← L-تيروسين ← L-دوبا ← دوبامين
- ثانوي: L-فينيل ألانين ← L-تيروسين ← p-تيرامين ← دوبامين
- ثانوي: L-فينيل ألانين ← m-تيروسين ← m-تيرامين ← دوبامين[20][21]
يُنتَج الدوبامين بشكل رئيسي من سلفه المركب الطليعي L-دوبا، والذي يمكن أن يُصطنَع بدروه بشكل غير مباشر من الحمض الأميني الضروري فينيل ألانين، أو بشكل مباشر من الحمض الأميني غير الضروري تيروسين.[22] توجد هذه الأحماض الأمينية في تركيب أغلب البروتينات، وهي متوافرة في العديد من الأغذية. على الرغم من وجود الدوبامين نفسه في عددٍ من أنواع الطعام، إلّا أنّه عند امتصاصه يكون غير قادرٍ على عبور الحاجز الدموي الدماغي، الذي يحيط ويحمي الدماغ.[23] لذلك ينبغي اصطناعه داخل الدماغ لتأمين نقله عصبياً.[23]
هناك عددٌ من الإنزيمات الضروري وجودها لتأمين اصطناع الدوبامين وفق المخطّط المرفَق. يُحوَّل L-فينيل ألانين إلى L-تيروسين بواسطة الإنزيم هيدروكسيلاز الفينيل ألانين (PAH)، والذي يُصنَّف ضمن إنزيمات هيدروكسيلاز الحمض الأميني العطري (AAAH)؛ ويقوم حينها الأكسجين الجزيئي (O2) ورباعي هيدرو البيوبتيرين (THB) بدور عامل مرافق. في خطوةٍ أخرى، يُحوَّل L-تيروسين إلى L-دوبا بواسطة الإنزيم هيدروكسيلاز التيروسين؛ ويقوم حينها رباعي هيدرو البيوبتيرين والأكسجين الجزيئي وأيونات الحديد الثنائي (2+Fe) بدور عاملٍ مرافق.[22] بعد ذلك يُحوَّل L-دوبا إلى دوبامين بواسطة الإنزيم نازعة كربوكسيل L-الحمض الأميني العطري (AADC؛ والذي يُعرَف أيضاً باسم نازعة كربوكسيل دوبا)، حيث تقوم فوسفات البيريدوكسال بدور عامل مرافق.[22]
يُستخدَم الدوبامين نفسه مركباً طليعياً (مادّة بادئة) في اصطناع الناقِلَين العصبيَّين نورإبينفرين وإبينفرين (أدرينالين).[22] يُحوَّل الدوبامين إلى نورإبينفرين بواسطة الإنزيم بيتا-هيدروكسيلاز الدوبامين (DBH)، ويقوم حينها الأكسجين الجزيئي O2 وحمض الأسكوربيك بدور العامل المرافق.[22] وبدوره يمكن أن يُحوَّل مركّب نورإبينفرين إلى أدرينالين بواسطة الإنزيم ناقلة ميثيل-N فينيل إيثانولامين (PNMT) مع دخول S-أدينوسيل-L-ميثيونين عاملاً مرافقاً للإنزيم.[22] أثناء عملية الاصطناع يكون من الضروري وجود كمّيات كافية من العوامل المرافقة، الأمر الذي يتطلّب اصطناعها؛[22] إذ أنّ النقص أو العوز في أحد الأحماض الأمينية أو العوامل المرافقة يمكن له أن يسبّب خللاً في اصطناع النواقل العصبية.[22]
التكسير
عدليُكسَّر الدوبامين إلى مستَقلَباته (نواتج عملية الأيض أو الاستقلاب) عبر مجموعة من الإنزيمات: أكسيداز أحادي الأمين (MAO) وناقلة ميثيل-O الكاتيكول (COMT) ونازعة هيدروجين الألدهيد (ALDH)، والتي تعمل على التوالي.[24] يقوم كلا الشكلَين المتماثِلَين لأكسيداز أحادي الأمين MAO-A وMAO-B بتكسير الدوبامين بشكلٍ فعّال في الجسم.[22] توجد عدّة مسارات مختلفة لتكسير الدوبامين، إلّا أنّ المُنتَج النهائي واحد، وهو حمض الهوموفانيليك (HVA)، والذي لا يمتلك أيّة فعّالية حيوية معروفة؛[24] وهو يُصفَّى من مجرى الدم بواسطة الكليتين ثم يُطرَح في البول.[24]
إنّ المسارات الرئيسية لاستقلاب الدوبامين إلى حمض الهوموفانيليك تكون على الشكل:
- دوبامين ← دوبال (DOPAL) ← دوباك (DOPAC) ← حمض الهوموفانيليك (HVA) بواسطة الإنزيمات MAO وALDH وCOMT على الترتيب.
- دوبامين ← 3-ميثوكسي تيرامين ← حمض الهوموفانيليك (HVA) بواسطة الإنزيمات COMT وMAO+ALDH على الترتيب.
استخدِمَت قياسات تركيز حمض الهوموفانيليك في بلازما الدم في بعض الدراسات على مرض الفصام من أجل تقدير مستويات فعّالية الدوبامين في الدماغ. إلّا أنّ صعوبةً واجهت هذا البحث، وهي ناجمةٌ عن المستويات المرتفعة من حمض الهوموفانيليك في البلازما والناتجة عن تكسير واستقلاب النورإبينفرين.[25][26]
على الرغم من أنّ الدوبامين يُكسَّر عادةً في الجسم عبر إنزيم أكسدة-اختزال (أكسيدوريدوكتاز)، إلّا أنّ المركّب عُرضةٌ أيضاً للأكسدة من التفاعل المباشر مع الأكسجين، الأمر الذي يعطي نواتجاً من كينونات بالإضافة إلى جذور حرّة؛[27] وهي مركّبات ذات سمية عصبية، وهناك دلائل أن تكسير الدوبامين وفق هذه الآليّة يمكن أن يساهم في فقدان العصبونات، وهو الأمر الذي يحدث في مرض باركنسون وغيره من الحالات العصبية الأخرى.[28]
الوظائف
عدلالتأثيرات الخلوية
عدل| العائلة | المستقبل | الجين | النوع | الآلية |
|---|---|---|---|---|
| مماثل لـD1 | D1 | DRD1 | مقترن بـGs | زيادة المستويات داخل الخلوية لـcAMP عبر تنشيط محلِّقة الأدينيلات. |
| D5 | DRD5 | |||
| مماثل لـD2 | D2 | DRD2 | مقترن بـGi | تخفيض المستويات داخل الخلوية لـcAMP عبر تثبيط محلِّقة الأدينيلات. |
| D3 | DRD3 | |||
| D4 | DRD4 | |||
| TAAR | TAAR1 | TAAR1 | مقترن بـGs مقترن بـGq |
زيادة المستويات داخل الخلوية لـcAMP وتركيز الكالسيوم داخل الخلوي |
يمارس الدوبامين تأثيراته عبر الارتباط بالمستقبلات الغشائية وتنشيطها. للدوبامين لدى البشر ألفة ارتباط عالية مع مستقبلات الدوبامين والمستقبل المرتبط بالأمين النزر 1 البشري (hTAAR1).[2][29] لدى الثدييات، تمّ تحديد خمسة أنواع فرعية من مستقبلات الدوبامين، وسُمّيت من D1 حتّى D5.[30] وجميعها تعمل مستقبلات تحوّلية، وكمستقبلات مقترنة بالبروتين ج، أي أنّها تمارس تأثيراتها عبر نظام رسول ثانٍ معقّد.[31] يمكن تقسيم هذه المستقبلات إلى عائلَتَين تعرفان باسم: مماثل لـD1 ومماثل لـD2. بالنسبة للمستقبلات المتواجدة على العصبونات في الجهاز العصبي، فالتأثير النهائي لتنشيط المستقبلات المماثلة لـD1 (وهي D1 وD5) يمكن أن يكون استثارةً (عبر فتح قنوات الصوديوم) أو تثبيطاً (عبر فتح قنوات البوتاسيوم)، أمّا التأثير النهائي لتنشيط المستقبلات المماثلة لـD2 (وهي D3 ،D2 وD4) هي عادةً تثبيط العصبون المستهدف.[31] بناءً على ذلك، فمن الخطأ وصف الدوبامين في حدّ ذاته كمركّب استثاري أو تثبيطي: فتأثيره على العصبون المستهدف يعتمد على أنواع المستقبلات المتواجدة على غشاء ذلك العصبون وعلى الاستجابات الداخلية لذلك العصبون بالنسبة للرسول الثاني cAMP.[31] مستقبلات D1 هي أكثر مستقبلات الدوبامين عدداً في الجهاز العصبي البشري، تليها مستقبلات D2، أمّا المستقبلات D4، D3 وD5 فهي متواجدة بأعداد منخفضة بشكل معتبَر.[31]
التخزين والتحرير والاسترداد
عدلTH: هيدروكسيلاز التيروسين
DOPA: ليفودوبا
DAT: ناقل الدوبامين
DDC: نازعة كربوكسيل دوبا
VMAT: ناقل أحادي الأمين الحويصلي 2
MAO: أكسيداز أحادي الأمين
COMT: ناقلة ميثيل-O الكاتيكول
HVA: حمض الهوموفانيليك
يعمل الدوبامين داخل الدماغ كناقل عصبي ومعدّل عصبي، ويتمّ التحكّم فيه عبر مجموعة من الآليات الشائعة عند جميع النواقل العصبية أحادية الأمين. بعد التخليق، يُنقَل الدوبامين من العصارة الخلوية في حويصلات مشبكية عبر ناقل مذاب، وهو الناقل أحادي الأميني الحويصلي VMAT2.[32] يُخزَّن الدوبامين في هذه الحويصلات حتى يُطرَح في الشقّ المشبكي. في معظم الحالات، يحدث تحرير الدوبامين عبر عملية تسمّى الإيماس والتي تحدث بسبب جهود الفعل، لكن يمكن أن يحدث كذلك بسبب نشاط المستقبل المرتبط بأمين نزر،TAAR1.[29] المستقبل TAAR1 ذو ألفة عالية للدوبامين وللأمينات النزرة ولبعض مستبدلات الأمفيتامين المتواجدة على طول الأغشية في الوسط داخل الخلوي الخاصّ بالعصبون قبل المشبكي؛[29] ويمكن أن يُعدِّل تنشيط المستقبل تأشيرَ الدوبامين عبر إحداث تثبيط استردادٍ للدوبامين ونقل عكسيٍ له وكذلك تثبيط النشاط العصبوني عبر آليات متنوّعة.[29][33]
عندما يبلغ الدوبامين المشبك يرتبط بمستقبلات الدوبامين وينشّطها.[34] يمكن أن تكون هذه الأخيرة مستقبلات دوبامين بعد-مشبكية تتواجد في الزوائد الشجرية (للعصبون بعد المشبكي)، أو مستقبلات ذاتية قبل مشبكية (مثل مستقبلي: D2sh وD3 قبل المشبكيين) تتواجد على غشاء محور طرفي (العصبون قبل المشبكي).[34] بعد أن يحصل العصبون بعد المشبكي على جهد فعل، تفكّ جزيئات الدوبامين بسرعة ارتباطها بالمستقبلات ويُعاد امتصاصها إلى العصبون قبل المشبكي عبر استردادٍ بواسطة ناقل الدوبامين أو ناقل أحادي الأمين الغشائي.[35] حين يعود الدوبامين إلى العصارة الخلوية، فهو إمّا أن يُفكَّك بواسطة أكسيداز أحادي الأمين أو يعاد شحنه في حويصلات بواسطة VMAT2 من أجل توفيره لإفرازات مستقبلية.
يتمّ التحكّم بمستوى الدوبامين خارج الخلوي في الدماغ عبر آليتين: انتقال طوري وتوتّري.[36] يحدث تحرير (إفراز) الدوبامين الطوري -كما هو الحال عند تحرير معظم النواقل العصبية بالجهار العصبي- مباشرةً بواسطة جهود الفعل في العصبونات المحتوية على الدوبامين.[36] ويحدث انتقال الدوبامين التوتّري حين تُحرَّر كمّيات صغيرة من الدوبامين من دون أن تسبقها جهود فعل قبل مشبكية.[36] يُنظَّم الانتقال التوتري بواسطة عوامل متنوّعة منها: نشاط عصبونات أخرى واسترداد الناقل العصبي.[36]
الجهاز العصبي
عدليلعب الدوبامين داخل الدماغ أدواراً مهمّة في الوظائف التنفيذية والتحكّم الحركي والتحفيز والتيَقُّط والتعزيز والمكافأة، وكذلك في الوظائف منخفضة المستوى مثل: إفراز الحليب والارتضاء الجنسي والغثيان. تشكّل المسارات ومجموعات الخلايا دوبامينية الفعل نظاماً دوبامينياً، وهو نظام تعديلي عصبي.
العصبونات دوبامينية الفعل (الخلايا العصبية المنتجة للدوبامين) قليلة العدد نسبياً (حوالي 400 ألف في الدماغ البشري،[37]) وأجسامها الخلوية متجمِّعة في مجموعات بمناطق معدودة وصغيرة نسبياً في الدماغ.[38] لكنّ محاورها تمتدّ إلى عدّة مناطق أخرى من الدماغ وتمارس تأثيرات قويّة على أهدافها.[38] تمّت موضعة (تحديد موضع) هذه الخلايا دوبامينية الفعل لأوّل مرة سنة 1964 بواسطة أنيكا دالستروم وكجيل فوكس [ملاحظة 2] اللذان رمزا لها بحروف A (إشارة إلى aminergic أي أمينيّة الفعل أو منتجة للأمينات).[39] تحتوي المواقع من A1 حتى A7 في مخططهما على الناقل العصبي نورإبينفرين، بينما تحتوي المناطق A8 حتى A14 على الدوبامين. المناطق دوبامينية الفعل التي تم تحديدها هي: المادّة السوداء (المجموعتين 8 و9)، والمنطقة السقيفية البطنية (المجموعة 10)، وتحت المهاد الخلفي (المجموعة 11)، والنواة المقوّسة (مجموعة 12)، والمنطقة العائرة (المجموعة 13) والنواة المحيطة بالبطين (المجموعة 14).
المادّة السوداء هي منطقة صغيرة في الدماغ المتوسط وأحد مكوّنات العقد القاعدية، وتتكوّن من جزئين، منطقة إدخال تسمّى الجزء المكتنز، ومنطقة إخراج تسمّى الجزء الشبكي. تتواجد العصبونات دوبامينية الفعل بشكل أساسي في الجزء المكتنز (مجموعة الخلية A8) وبجوارها (المجموعة A9).[38] تلعب العصبونات دوبامينة الفعل الممتدة من المادّة السوداء إلى الجسم المخطّط الظهري عبر المسار السوداوي المخطّطي دوراً معتبراً في وظيفة الحركة وفي تعلّم مهارات حركية جديدة لدى البشر.[40] هذه العصبونات حسّاسة ومعرَّضة بشكلٍ خاصّ للتضرّر (التلف)، وينتج عن موت كمّية كبيرة منها متلازمة باركنسونية.[41]
المنطقة السقيفية البطنية (VTA) هي منطقة أخرى في الدماغ المتوسط، تمتدّ أبرز مجموعات عصبونات VTA دوبامينية الفعل إلى القشرة أمام الجبهية عبر المسار الوسطي القشري، كما تمتدّ مجموعة أخرى صغيرة إلى النواة المتكئة عبر المسار الوسطي الطرفي. يسمّى هذان المساران معاً باسم الامتداد الوسطي القشري الطرفي.[38][40] ترسل الـVTA كذلك امتداداتٍ دوبامينية الفعل نحو اللوزة الدماغية والتلفيف الحزامي والحصين والبصلة الشمّية.[38][40] تلعب العصبونات الوسط قشرية الطرفية دوراً في المكافأة وجوانب تحفيز أخرى.[40]
يملك تحت المهاد الخلفي عصبونات دوبامينية تمتدّ إلى الحبل الشوكي لكنّ وظيفتها غير معروفة جيّداً. توجد بعض الأدلّة على أنّ الاضطرابات في هذه المنطقة تلعب دوراً في متلازمة تململ الساقين، وهي حالة يعاني فيها المرضى من صعوبةٍ في النوم بسبب شعور قسري عارم لتحريك أجزاء الجسم باستمرار وخاصّة الساقين.[42]
تملك النواة المقوّسة والنواة المحيطة بالبطين في تحت المهاد عصبونات دوبامينية تشكّل امتداداً مهمّاً هو المسار الأحدوبي القمعي، الذي يمتدّ إلى الغدّة النخامية، حيث يؤثّر هناك على إفراز هرمون البرولاكتين. إنّ الدوبامين هو المثبّط العصبي الصمّاوي الأساسي لإفراز البرولاكتين من الغدّة النخامية الأمامية. يُفرَز الدوبامين المخلَّق بواسطة العصبونات في النواة المقوّسة داخل الجهاز النخامي البوابي الخاصّ بالبارزة الناصفة التي تزوّد الغدّة النخامية. الخلايا المفرزة للبرولاكتين وفي غياب الدوبامين تُفرز البرولاكتين باستمرار، ويقوم الدوبامين بتثبيط هذه العملية. في سياق تنظيم إفراز البرولاكتين، يسمّى الدوبامين عامل تثبيط البرولاكتين أو الهرمون المثبّط للبرولاكتين أو برولاكتوستاتين (مثبّط البرولاكتين).[43]
تمتدّ المنطقة العائرة الواقعة بين النواة المقوّسة والنواة المحيطة بالبطين إلى عدّة مناطق من تحت المهاد وتشارك في التحكّم بالهرمون المطلق للغونادوتروبين الضروري لتنشيط نموّ الأجهزة التناسلية الذكرية والأنثوية.
تتواجد مجموعة إضافية من العصبونات دوبامينية الفعل في شبكية العين.[44] هذه العصبونات هي خلايا أماكرين، ويعني ذلك أنّها لا تملك محوارات (محاور عصبية)،[44] وتحرّر الدوبامين إلى الوسط خارج الخلوي وهي نشطة بشكل خاص خلال ساعات النهار وتصبح خامدة في الليل.[44] يعمل هذا الدوبامين الشبكي على تحسين نشاط الخلايا المخروطية في الشبكية مع تثبيط الخلايا العصوية من أجل زيادة التحسّس للألوان والتباين في حالة الضوء الساطع، على حساب تحسّس منخفض حين يكون الضوء خافتاً.[44]
العقد القاعدية
عدلأكبر وأهمّ مصادر الدوبامين في الفقاريات هي المادّة السوداء والمنطقة السقيفية البطنية، ولهاتين البُنيتين صلة وثيقة ببعضهما ودور وظيفي متماثل في العديد من النواحي.[38] فكلاهما مكوِّن من مكوّنات العقد القاعدية، وهي شبكة معقّدة من البُنى المتواجدة أساساً في قاعدة الدماغ الأمامي.[38] أكبر مكوّن للعقد القاعدية هو الجسم المخطّط.[45] ترسل المادة السوداء امتدادات دوبامينية الفعل إلى الجسم المخطّط الظهري، في حين ترسل المنطقة السقيفية البطنية امتداداً دوباميني الفعل من نوع مماثل إلى الجسم المخطّط البطني.[38]
إنّ التقدّم في فهم وظائف العقد القاعدية كان بطيئاً.[45] تقترح أشهر الفرضيات -المصرّح بها على نطاق واسع- أنّ القعد القاعدية تلعب دوراً رئيسياً في اختيار الفعل.[46] تقترح نظرية اختيار الفعل في أبسط هيئاتها أنّه حين يكون شخص أو حيوان في وضعية يجب عليه فيها القيام بفعل من عدّة أفعال ممكنة، يحدّد النشاط في العقد القاعدية أيّ فعل سيُنَفَّذ عبر تحرير ذلك الفعل من التثبيط مع الاستمرار في منع أنظمة الفعل الأخرى التي إنْ تمّ تنشيطها ستقوم بتوليد أفعال منافِسة.[47] وعليه فالعقد القاعدية -في هذا المفهوم- مسؤولةٌ عن بدء التصرّفات والأفعال، ولكن ليس عن تفاصيل طريقة تنفيذها؛ بعبارةٍ أخرى، تشكّل العقد القاعدية نظام اتخاذ القرار.[47]
يمكن تقسيم العقد القاعدية إلى عدّة قطاعات، لكلّ واحدٍ منها دور في التحكّم بنوعٍ معيّن من الأفعال.[48] تعمل القطاعات البطنية من العقد القاعدية (تحتوي على الجسم المخطّط البطني والمنطقة السقيفية البطنية) على أعلى مستوى في الهرمية، وتختار الأفعال على مستوى الكائن بأكمله.[47] أمّا القطاعات الظهرية (تحتوي على الجسم المخطّط الظهري والمادّة السوداء) فتعمل على مستويات منخفضة، وتختار عضلات وحركات محدّدة تُستخدم لتنفيذ نمط سلوكٍ معيّن.
يساهم الدوبامين في عملية اختيار الفعل على الأقل بطريقتين مهمّتين. الأولى، أنّه يحدّد «العتبة» لبدء الأفعال.[46] كلّما كان نشاط الدوبامين أعلى كلما قلّ الدافع المطلوب لاستثارة تصرّف معيّن.[46] كنتيجة لذلك، تقود مستويات الدوبامين المرتفعة إلى مستويات مرتفعة من النشاط الحركي والسلوك الاندفاعي، أمّا المستويات المنخفضة من الدوبامين فتقود إلى فتور وردّات فعل بطيئة.[46] يتميّز مرض باركنسون -الذي تكون فيه مستويات الدوبامين في مسارات المنطقة السوداء منخفضة بشكل كبير- بالتيبّس وصعوبة في بدء الحركة، لكن حين يواجه الأشخاص المصابون به محفّزاً قويّاً مثل خطر كبير فإن تصرّفاتهم يمكن أن تكون قويّة ونشيطة كنظيراتها لدى الأصحّاء.[49] بشكل معاكس، فيمكن للعقارات التي تزيد إفراز الدوبامين مثل الكوكايين أو الأمفيتامين أن تنتج مستويات نشاط حادّة -بما في ذلك عند الدرجات القصوى- هياج نفسي حركي وحركات نمطية.[50]
التأثير الثاني المهمّ للدوبامين هو أنّه يعمل كإشارة «تعليم».[46] عندما يُتبَع فعلٌ ما بحدوث زيادةٍ في نشاط الدوبامين فإنّ مسار (دارة) العقد القاعدية يُعَدَّل بطريقة تجعل نفس الاستجابة أسهل للاستثارة حين تحدث وضعيات مماثلة في المستقبل.[46] هذا نوع من الإشراط الاستثابي ويلعب فيه الدوبامين دور إشارة المكافأة.[47]
المكافأة
عدلفي اللغة المستخدمة لمناقشة نظام المكافأة في الدماغ، تُعرّف المكافأة بأنّها الخاصية الجاذبة والمحفّزة في المنبّه، والتي تحثّ على سلوك اشتهائي (ترغّبي) -ويُعرف كذلك بسلوك التقرّب- وبالسلوك الاستهلاكي.[51] المنبّه المكافِئ هو المنبّه الذي يحثّ الكائن على الاقتراب منه واختيارِ استهلاكه.[51] تعدّ اللذّة والتعلّم (الإشراط الكلاسيكي والاستثابي) وسلوك التقرّب هي الوظائف الثلاث للمكافأة.[51] بصفتها جانباً ومظهراً للمكافأة توفّر اللذّة تعريفاً للمكافأة، لكن رغم كون جميع المنبّهات التلذّذية مكافِئة؛ ليست كلّ المنبهات المكافِئة تلذّذية (مثل المكافآت الخارجية كالنقود).[51][52] يُعكَس الجانب التحفزّي أو الترغيبي للمنبّهات المكافِئة عبر سلوك التقرّب الذي تستحِثُّه، في حين أنّ اللذّة الناتجة من المكافآت الداخلية تنتُج من استهلاك هذه المكافآت بعد الحصول عليها.[51] من النماذج النفسية العصبية التي تميّز هذين المكوّنين للمنبه الداخلي المكافِئ هو نموذج التميّز التحفيزي الذي يقابل فيه «الابتغاء»[ملاحظة 3] أو الرغبة[ملاحظة 4] (وبشكل أقلّ «السعي»[ملاحظة 5][53]) السلوك الاشتهائي أو التقرّبي في حين يقابل «الإعجاب»[ملاحظة 6] أو «اللذّة»[ملاحظة 7] السلوك الاستهلاكي.[7][51][54] يصبح «الابتغاء» لدى البشر المدمنين للعقاقير منفصلاً عن «الإعجاب» مع ازدياد الرغبة في تعاطي العقاقير، في حين أنّ اللذّة المتَحصَّل عليها من التعاطي تنخفض بسبب تحمّل الدواء.[7]
يعمل الدوبامين داخل الدماغ جزئياً كإشارة مكافأة عامّة. تُشفِّر استجابةُ دوبامينٍ أوّليةٍ لمنبّه مكافئٍ معلومةً عن تميّز وقيمة وسياق المكافأة.[51] في سياق التعلّم المتّصل بالمكافأة يعمل الدوبامين كذلك كإشارة لخطأِ التنبؤِ بالمكافأة، ويعني ذلك مقدار ودرجة عدم توقّع قيمة المكافأة.[51] تبعاً لهذه الفرضية الخاصة بفولفرام شولتز [ملاحظة 8]، فإنّ المكافآت المتوَقَّعَة لا تُنتِج استجابةَ دوبامينٍ ثانيةٍ في بعض الخلايا دوبامينية الفعل، لكن المكافآت غير المتوَقَّعة أو التي تفوق التوقّع تُنتج زيادةً وجيزة البقاء في الدوبامين المشبكي، بينما يسبّب إغفال مكافأة متوقَّعَة انخفاضاً في تحرير الدوبامين إلى أقلّ من المعدّلات الوسطية.[51] حصلت فرضية «خطأ التنبّؤ» على اهتمامٍ خاصٍّ من المختصّين في العلوم العصبية الحاسوبية، لأنّ هنالك طريقةُ تعلّمٍ حاسوبيةٍ مؤثّرةٍ، تعرَف باسم تعلّم الفرق الزمني، تَستخدِم إشارةً بشكل كبير لتُشفير خطأ التنبؤ.[51] قاد هذا التقارب بين الفرضية والبيانات إلى تآثرات خصبة بين علماء الأعصاب وعلماء الحاسوب المهتمّين بتعلّم الآلة.[51]
تُظهِر أدلّة من تسجيلات مسرى مكروي من أدمغة حيوانات أنّ عصبونات الدوبامين في المنطقة السقيفية البطنية (VTA) والمادّة السوداء تُنشَّط بقوّة بواسطة مجموعة متنوّعة من أحداث المكافأة.[51] إنّ عصبونات الدوبامين المستجيبة للمكافأة هذه في السقيفية البطنية والمادّة السوداء حاسمة للإدراك المتعلّق بالمكافأة وتعمل كمكوّن مركزي لنظام المكافأة.[7][55][56] تختلف وظيفة الدوبامين في كلّ امتدادٍ محواريِّ من السقيفية البطنية والمادّة السوداء،[7] على سبيل المثال يُعيِّن امتداد قشرة النواة المتّكئة في السقيفية البطنية التميّز المُرغِب «ابتغى» للمنبّهات المكافئة والإلماعات المرتبطة بها، وتُحَدِّث القشرة الجبهية الحجاجية الخاصّة بالسقيفية البطنية قيمة الأهداف المختلفة تماشياً مع تميّزها المرغِب، تتوسّط امتدادات لوزة السقيفية البطنية وحُصَيْنِها تقوية الذكريات المتعلّقة بالمكافأة؛ ولكلا مسارَيْ لبّ النواة المتّكئة الخاصّة بالسقيفية البطنية والجسم المخطّط الخاصّ بالمادّة السوداء دورٌ في تعلّم الاستجابات الحركية التي تسهّل اكتساب منبّهات مكافئة.[7][57] يبدو أنّ لبعض النشاط داخل امتدادات السقيفية البطنية دوبامينية الفعل صلةٌ بالتنبّؤ بالمكافأة كذلك.[7][57]
اللذّة
عدلفي حين أنّ للدوبامين دوراً مركزيًّا في إحداث «الرغبة» المرتبطة باستجاباتِ تصرّفٍ تقرّبِيٍّ أو اشتهائِيٍّ للمنبّهات المكافئة، أظهرت دراسات مفصّلة أنّ الدوبامين لا يمكن مساواته ببساطة «بالإعجاب» التلذّذي أو المتعة، كما تَبيّنَ من استجابة السلوك الاستهلاكي. للانتقال العصبي للدوبامين دورٌ في بعض -وليس كل- جوانب الإدراك المتعلّق باللذّة، وذلك لأن مراكز اللذّة حُدّدت داخل نظام الدوبامين (قشرة النواة المتّكئة) وخارجه (الشاحبة البطنية والأنوية شبه العضدية).[54][58] على سبيل المثال، التنبيه الكهربائي المباشر لمسارات الدوبامين باستخدام أقطاب كهربائية مزروعة في الدماغ يتمّ الإحساس به على أنّه تلذّذي، والعديد من أنواع الحيوانات مستعدّة وراغبة في العمل للحصول عليه. تُخفِّض الأدوية المضادّة للذهان مستويات الدوبامين وتميل إلى إحداث انعدام التلذّذ، وهو انخفاضٌ في القدرة على الشعور باللذّة.[59] تزيد العديد من الأفعال التلذّذية مثل الجماع والأكل ولعب ألعاب الفيديو من إفراز الدوبامين.[60] تؤثّر جميع العقاقير التي يمكن إدمانها بشكل مباشر أو غير مباشر على الانتقال العصبي للدوبامين في النواة المتّكئة،[7] وتزيد هذه العقاقير حين يتمّ تناولها بصفة متكرّرة بجرعات مرتفعة التركيز من «الرغبة» إليها، مؤدّيةً إلى تعاطٍ قهريٍّ وإدمان، وذلك عبر تحسّس لتميُّز تحفيزي محتمل.[54] تتضمن العقاقير التي تزيد من تراكيز الدوبامين المشبكي المنشّطات النفسية مثل الميثامفيتامين والكوكايين. تُولّد هذه المنشّطات سلوكياتِ «رغبة»، لكنها لا تعدّل بشكلٍ كبير من تعابير اللذّة أو تغيّر من مستويات الإشباع.[54][61] مع ذلك، تحدث العقاقير الأفيونية مثل الهيروين والمورفين زيادات في مقدار سلُوكَي «الإعجاب» و«الرغبة».[54] فضلاً عن ذلك، فإنّ الحيوانات التي أصبح فيها مسار الدوبامين السقيفي البطني غير نشط لا تطلب أو تسعى للحصول على الطعام، وستموت جوعاً إن تركت لوحدها، لكن إن وُضِع الطعام في أفواهها ستقوم باستهلاكه وإبداء تعابير تشير إلى التلذّذ.[62]
وجدت دراسة سريرية، والتي اهتمت بتقييم تأثير سلف الدوبامين (ليفودوبا) ومضادّ الدوبامين (ريسبيريدون) والعلاج الوهمي على استجابات المكافأة بالنسبة للموسيقى - بما في ذلك مقدار اللذّة التي شُعِر بها أثناء قشعريرات الموسيقى المقاسة بواسطة تغيُّرات في نشاط كهربية الجلد بالإضافة إلى التقديرات الذاتية؛ أنّ التلاعب بالانتقال العصبي للدوبامين ثنائي الاتجاه يُنظّم إدراك اللذّة (خاصّة التأثير التلذّذي للموسيقى) لدى البشر.[63][64] أوضحت الدراسة أنّ زيادة الانتقال العصبي للدوبامين تعمل كشرطٍ حتميّ في الاستجابات التلذّذية الاستمتاعية للموسيقى لدى البشر.[63][64]
خارج الجهاز العصبي
عدللا يتجاوز الدوبامين الحاجز الدموي الدماغي، لذا فإنّ تخليقه ووظائفه في الأعضاء الطرفية مستقلٌ إلى حدٍّ كبير عن تخليقه ووظائفه في الدماغ.[23] تدور كمّيّة معتبرة من الدوبامين في الدورة الدموية، لكنّ وظيفته هنالك ليست واضحة بالكامل.[24] يتواجد الدوبامين في بلازما الدم بمستوياتٍ مقاربةٍ لمستويات الإبينيفرين، لكن لدى البشر، فإنّ أكثر من 95% من الدوبامين الموجود في البلازما يكون على شكل كبريتات الدوبامين، وهو مرافق ينتجه إنزيم SULT1A3 العاملة على الدوبامين الحرّ.[24] تُخلّق معظم كبريتات الدوبامين هذه في المسراق الذي يحيط بأجزاءٍ من الجهاز الهضمي.[24] يُعتقد أنّ تخليق كبريتات الدوبامين هو آلية لإزالة سُمِيّة الدوبامين الذي تمّ تناوله عبر الطعام أو إنتاجه عبر عملية هضمية، فمستويات البلازما منه تتضاعف أكثر من 50 مرة بعد تناول وجبة.[24] كبريتات الدوبامين ليس لها دور حيوي معروف ويتم طرحها في البول.[24]
يمكن أن تُخلَّق الكمّية الصغيرة نسبياً من الدوبامين غير المرافق في مجرى الدم بواسطة الجهاز العصبي الودّي أو الجهاز الهضمي أو ربما بواسطة أعضاء أخرى.[24] ويمكن أن يعمل على مستقبلات الدوبامين في الأنسجة الطرفية، أو يتعرّض للأيض أو يُحوَّل إلى نورإبينفرين بواسطة إنزيم بيتا-هيدروكسيلاز الدوبامين الذي يُفرَز في مجرى الدم بواسطة لب الغدة الكظرية.[24] تتواجد بعض مستقبلات الدوبامين في جدران الشرايين، حيث تعمل هناك كموسّع وكمثبّط لإفراز النورإبينفرين.[65] قد تُنشَّط هذه الاستجابات بواسطة إفراز الدوبامين من الجسم السباتي تحت ظروف انخفاض الأكسجين، لكن من غير المعروف إن كانت مستقبلات الدوبامين الشريانية تقوم بأدوار حيوية مفيدة أخرى.
فضلاً عن دوره في تعديل تدفّق الدم، توجد العديد من الأجهزة التي يدور فيها الدوبامين بمناطق محدودة ويؤدّي وظيفة إفراز خارجي أو تأشير نظير صماوي.[24] من الأجهزة الملحقة التي يلعب فيها الدوبامين دوراً مهمّاً كذلك كلّ من الجهاز المناعي والكليتين والبنكرياس.
يعمل الدوبامين في الجهاز المناعي عبر المستقبلات المتواجدة في الخلايا المناعية، وخاصّة الخلايا اللمفاوية.[66] يمكن للدوبامين كذلك التأثير على الخلايا المناعية في الطحال ونخاع العظام وجهاز الدوران.[67] فضلاً عن ذلك، يمكن تخليق الدوبامين وإفرازه بواسطة الخلايا المناعية في حدّ ذاتها.[66] يقوم التأثير الرئيسي للدوبامين على الخلايا اللمفاوية على تخفيض مستوى تنشيطها، إلّا أنّ الدلالة الوظيفية لهذا النظام غير واضحة، لكنّه يوفّر طريقة ممكنة لحدوث تآثرات بين الجهاز العصبي والجهاز المناعي، وقد يكون له دورٌ في بعض اضطرابات المناعة الذاتية.[67]
يتواجد النظام الكلوي دوباميني الفعل في خلايا الكليون بالكلية، حيث تتواجد جميع الأنواع الفرعية من مستقبلات الدوبامين.[68] يُخلَّق الدوبامين هنالك أيضًا بواسطة خلايا الكليون ويتم تفريغه في السائل الكليوني. تشمل وظائفه كذلك زيادة تزويد الكليتين بالدمّ، وزيادة معدل الترشيح الكبيبي، وزيادة طرح الصوديوم في البول. ومنه، يمكن أن تقود عيوب في عمل الدوبامين الكلوي إلى انخفاض في طرح الصوديوم وزيادة في تطوّر ارتفاع ضغط الدم. يوجد دليل قوي على أنّه يمكن أن ينتج عن أخطاءٍ في تخليق الدوبامين أو في مستقبلاته عددٌ من الأمراض بما في ذلك الإجهاد التأكسدي والاستسقاء، وكذلك إمّا ارتفاع ضغط الدم الوراثي أو الأساسي. يمكن للإجهاد التأكسدي أن يسبّب بدوره ارتفاع ضغط الدم.[69] يمكن أن تحدث عيوب في هذا النظام بسبب عوامل وراثية أو ضغط الدم المرتفع.[70]
إنّ دور الدوبامين في البنكرياس معقّد نوعاً ما. يتكوّن البنكرياس من جزئين: جزء غُدِي خارجي وآخر صمّاوي. يفرز الجزء الغُدي الخارجي إنزيمات هضمية ومواد أخرى -بما في ذلك الدوبامين- في الأمعاء الدقيقة. وظيفة هذا الدوبامين المفرَز بعد دخوله الأمعاء الدقيقة غير واضحة تماماً، ومن الاحتمالات أنّه يحمي الغشاء المخاطي المعوي من التضرّر ويخفّض من الحركة المعدية المعوية (وهي المعدّل الذي يتحرّك به المحتوى داخل الجهاز الهضمي).[71]
تُشكِّل جزر لانغرهانس الجزء الصمّاوي من البنكرياس وتقوم بتخليق وطرح هرمونات منها الإنسولين إلى مجرى الدم. يوجد دليل على أن خلايا بيتّا في هذه الجزر التي تخلق الأنسولين تحتوي على مستقبلات دوبامينية، وأن الدوبامين يعمل على تخفيض كمّية الإنسولين التي تُفرزها. مصدر الدوبامين فيها غير معروف بوضوح، ويمكن أن يأتي من الدوبامين الذي يسري في مجرى الدم والذي مصدره الجهاز العصبي الودّي، أو ربّما يتمّ تخليقه موضعياً بواسطة أنواع أخرى من الخلايا البنكرياسية.
الاستخدامات الطبية
عدليُباع الدوبامين كدواء مُصنَّعٍ تحت الأسماء التجارية: إنتروبين - دوباستات - ريفيمين؛ وأسماء أخرى. وهو في قائمة الأدوية الأساسية النموذجية لمنظمة الصحة العالمية.[72] يُستخدم في الغالب كدواء محفّز في علاج انخفاض ضغط الدم الحادّ وانخفاض معدل دقات القلب وتوقف القلب، وهو مهمّ بشكل خاصّ في معالجة هذه الأمراض لدى الأطفال حديثي الولادة.[73] يُعطى الدوبامين عبر الحقن في الوريد، وبما أنّ عمر النصف الخاص به في البلازما قصير جدا -حوالي دقيقة واحدة عند البالغين، دقيقتين لدى الرُّضّع وحتى خمس دقائق لدى الخُدَّج- فعادةً ما يُعطى عبر معالجة وريدية مستمرّة بدل حقنة واحدة.[74]
اعتماداً على الجرعة تشمل تأثيرات الدوبامين: زيادة في طرح الكلى للصوديوم، وزيادة في التبوّل، وزيادة في معدّل دقّات القلب، وزيادة في ضغط الدمّ. عند تناوله بجرعات منخفضة، يعمل عبر الجهاز العصبي الودّي لزيادة قوّة تقلّصات عضلة القلب ومعدّل دقّاته، ومنه زيادة النتاج القلبي وضغط الدم.[75] يمكن للجرعات العالية كذلك التسبّب في تضيق الأوعية التي تسبّب بدورها ضغط الدم.[75][76] تقول كتب طبية قديمة أن الجرعات المنخفضة جدا يمكن أن تحسّن عمل الكلية من دون آثار جانبية أخرى، لكن خلُصت مراجعات حديثة إلى أن الجرعات المنخفضة بذلك القدر ليست فعّآلة ويمكن أن تكون ضارّة في بعض الأحيان.[77] في حين أن بعض التأثيرات تظهر من تنبيه مستقبلات الدوبامين، تنتج التأثيرات الرئيسية في القلب والأوعية الدموية من الدوبامين العامل على المستقبلات α1 وβ1 وβ2 أدرينالية الفعل.[78][79]
تشمل التأثيرات الجانبية للدوبامين: تأثيرات سلبية على وظيفة الكلية ودقّات قلب غير منتظمة. تمّ تحديد الـLD50 أو الجرعة المميتة التي يُتَوقّع أن تكون مميتة لـ 50% من متناوليها عند: 59 ملغ/كلغ (فأر، حقن وريدي)، 95 ملغ/كلغ (فأر، حقن داخل الصفاق)، 163 ملغ/كلغ (جرذ، حقن داخل الصفاق)، 79 ملغ/كلغ (كلب، حقن وريدي).[80]
تتوفر هيئة مفلورة من ليفودوبا تُعرف باسم فلورودوبا للاستخدام في التصوير المقطعي بالإصدار البوزيتروني لتقييم وظيفة المسار السوداوي المخططي.[81]
الأمراض والاضطرابات
عدليلعب نظام الدوبامين دوراً مركزياً في العديد من الأمراض الطبّية بما في ذلك مرض باركنسون واضطراب نقص الانتباه مع فرط النشاط ومتلازمة توريت والفصام والاضطراب ثنائي القطب والإدمان. فضلاً عن الدوبامين بحدّ ذاته، فتوجد العديد من العقاقير التي تعمل على أنظمة الدوبامين في أجزاء متنوّعة من الدماغ أو الجسم، ويُستخدم بعضها لأغراضٍ طبّية أو ترفيهية. طوَّرَ علماء الكيمياء العصبية كذلك مجموعةً متنوّعةً من عقاقير الأبحاث التي يرتبط بعضها بإلفة عالية مع أنواع محدّدة من مستقبلات الدوبامين، وتعمل إمّا على تفعيل أو تعطيل تأثيراتها، والعديد من العقاقير التي تؤثّر على جوانب أخرى من فيسيولوجية الدوبامين،[82] بما في ذلك مثبّطات ناقل الدوبامين ومثبّطات ناقل أحادي الأمين الحويصلي ومثبّطات الإنزيم.
تشيّخ الدماغ
عدلذكرت العديد من الدراسات حدوث انخفاض متعلّق بالعمر في تخليق الدوبامين وكثافة مستقبلات الدوبامين (عدد المستقبلات) في الدماغ.[83] وقد تبيّن أنّ هذا الانخفاض يحدث في منطقة الجسم المخطّط والقشرة الخارجية له.[84] كما تمّ توثيق انخفاضات في المستقبلات D1 وD2 وD3.[85][86][87] يُعتقد أنّ انخفاض الدوبامين مع تقدّم العمر مسؤولٌ عن العديد من الأعراض العصبية التي يزيد تواترها مع العمر، مثل انخفاض مدى تحريك الذراع وزيادة في التقبّض.[88] يمكن أن تسبّب تغيّراتُ مستويات الدوبامين كذلك تغيراتٍ في المرونة الإدراكية المتعلقة بتقدّم العمر.[88]
تُظهر نواقل عصبية أخرى مثل سيروتونين وحمض الجلوتاميك كذلك انخفاضاً في التخليق مع تقدّم السن.[87][89]
تصلّب متعدد
عدلأفادت دراسات أنّ اختلال التوازن في الدوبامين يؤثّر على التعب في التصلّب المتعدد.[90] يمنع الدوبامين لدى المرضى بالتصلّب المتعدّد إنتاج إنترلوكين 17 وIFN-γ بواسطة خلايا الدمّ المحيطية وحيدة النواة.[91]
مرض باركنسون
عدلمرض باركنسون هو اضطرابٌ متعلّقٌ بالعمر، ويتميّز باضطرابات في الحركة مثل: تيبّس الجسم وبطء الحركة وارتعاش الأطراف أثناء عدم استخدامها.[49] في المراحل المتقدّمة يتطوّر المرض إلى الخرف ثمّ إلى الوفاة في النهاية.[49] تحدث الأعراض الأساسية بسبب فقدان الخلايا المفرِزة للدوبامين في المادّة السوداء.[92] هذه الخلايا الدوبامينية عرضة بشكلٍ خاصّ للتضرّر بما في ذلك: التهاب الدماغ والارتجاجات الرياضية المتكرّرة، وبعض أنواع التسممات الكيميائية بموادٍ مثل MPTP؛ حيث تؤدّي تلك الأضرار إلى خسارة معتبرة لهذه الخلايا تنتج عنها متلازمة باركنسون مماثلة في خصائصها الرئيسية لمرض باركنسون.[93] إنّ معظم حالات مرض باركنسون مجهولة السبب ولا يمكن فيها تحديد سبب موت الخلايا.
العلاج الأكثر شيوعاً واستخداماً لمعالجة باركنسون هو تناول ليفودوبا السلف الأيضي للدوبامين.[23] يحوَّل ليفودوبا إلى دوبامين في الدماغ وأنحاء مختلفة من الجسم بواسطة الإنزيم نازعة كربوكسيل دوبا.[22] يُستخدم مركب ليفودوبا بدل الدوبامين في حدّ ذاته لأنه -بخلاف الدوبامين- قادرٌ على تجاوز الحاجز الدموي الدماغي.[23] وغالباً ما يتمّ تناوله مع مثبط إنزيم لنزع كربوكسيلٍ محيطي مثل كاربيدوبا أو بنسيرازيد، لتخفيض الكمّية المحوّلة إلى دوبامين في المنطقة المحيطية وبالتالي زيادة كمّية ليفودوبا التي تدخل إلى الدماغ.[23] حين يتمّ تناول ليفودوبا بانتظام لمدّة طويلة، عادةً ما تبدء مجموعة متنوّعة من الآثار الجانبية غير السارّة بالظهور مثل خلل الحركة، ورغم ذلك فإنّ ليفودوبا يعتبر أفضل خيار للعلاج طويل الأمد لمعظم حالات مرض باركنسون.[23]
لا يمكن للعلاج بليفودوبا استعادة الخلايا الدوبامينية المفقودة، لكنه يتسبّب بأن تقوم الخلايا المتبقية بإنتاج المزيد من الدوبامين، ومنه تعويض الكمية المطلوبة منه ولو بدرجة معينة.[23] في المراحل المتقدّمة يبدأ العلاج بالفشل لأنّ فقدان الخلايا يكون كبيراً لدرجة أنّ الخلايا المتبقيّة لا يمكنها إنتاج الدوبامين بشكل كافٍ، وذلك بغضّ النظر عن مستويات ليفودوبا.[23] بعض الأدوية التي تحسّن من وظيفة الدوبامين مثل بروموكريبتين وبيرغوليد تُستخدم أحياناً كذلك لعلاج الباركنسونية، لكن في معظم الحالات وجد أن ليفودوبا يُعطي أفضل مفاضلة بين التأثيرات الإيجابية والتأثيرات الجانبية السلبية.[23]
الأدوية دوبامينية الفعل التي تُستخدم لعلاج مرض باركنسون يصاحبها في بعض الأحيان تطوّر متلازمة خلل تنظيم الدوبامين، والتي تتضمّن الاستخدام المفرط للدواء دوباميني الفعل والدواء الحاثّ على القيام القهري بنشاطات مكافأة طبيعية مثل القمار والجماع.[94][95] هذه التصرّفات مماثلة للتصرّفات الملاحظَة لدى الأفراد المرضى بإدمان سلوكي.[94]
إدمان العقاقير والمنشطات النفسية
عدلتمارس العقاقير، مثل الكوكايين ومشتقّات الأمفيتامين (بما في ذلك الميثامفيتامين) وآديرال وميثيل فينيدات (المسوَّق باسم ريتالين أو كونسيرتا) وMDMA وغيرها من المنشّطات النفسية، تأثيراتها جزئياً أو كلّياً عبر زيادة مستويات الدوبامين في الدماغ عبر آليات متنوّعة.[96] الكوكايين وميثيل فينيدات هي مركّبات معيقة للنواقل أو مثبّطات استرداد والتي تثبّط بشكل غير تنافسي استرداد الدوبامين، وهذا يتسبّب في زيادة تراكيز الدوبامين في الشقّ المشبكي.[97][98]:54–58 كما هو الحال مع الكوكايين، تزيد كلّ من مشتقّات الأمفيتامين والأمفيتامين تراكيز الدوبامين في الشقّ المشبكي، لكن بآلياتٍ مختلفة.[33]:147–150
تشمل تأثيرات المنشّطات النفسية زيادةً في معدّل دقّات القلب وحرارة الجسم والتعرّق وتحسّن في اليقظة والانتباه والتحمّل، بالإضافة إلى زيادة في اللذّة الناتجة عن نشاطات مكافئة؛ أمّا الجرعات المرتفعة فتحدث حالات هياج وقلق وحتّى فقدان الارتباط بالواقع.[96] إنّ إمكانية إدمان العقاقير عالية بسبب تأثيراتها التنشيطية على نظام المكافأة بواسطة الدوبامين في الدماغ.[96] مع ذلك فبعض هذه العقاقير يمكن أن يكون مفيداً -عند جرعات منخفضة- لعلاج اضطراب نقص الانتباه مع فرط النشاط وكذلك النوم القهري.[99][100] من عوامل التفريق المهمّة بين هذه العقاقير هو بداية ومدّة تأثيراتها،[96] فالكوكايين يحدِث مفعوله بعد ثوانٍ من حقنه أو استنشاقه على هيئة قاعدة حرّة وتدوم تأثيراته من 5 إلى 90 دقيقة.[101] هذه الوظيفة السريعة والقصيرة تجعل تأثيراته سهلة الملاحظة وتعطيه احتمالية إدمان عالية.[96] على العكس، فإنّ ميثيل فينيدات المتناول على شكل حبوب يمكن أن يستغرق ساعتين ليصل إلى قمّة مستوياته في مجرى الدم،[99] وحسب التكوين يمكن أن تدوم تأثيراته حتّى 12 ساعة.[102] هذه التأثيرات البطيئة والمستمرّة تخفّض من إمكانية إساءة الاستخدام وتجعل ميثيل فينيدات أكثر فائدة في علاج اضطراب نقص الانتباه مع فرط النشاط.[99]
تُحدث مجموعة متنوّعة من العقاقير المسبّبة للإدمان زيادة في نشاط الدوبامين المتعلّق بالمكافأة.[96] تعزّز المنشّطات مثل النيكوتين والكوكايين والميثامفيتامين زيادة مستويات الدوبامين، والتي تبدو أنّها العامل الأساسي في التسبّب بالإدمان. بالنسبة للعقاقير الأخرى المسبّبة للإدمان مثل هيروين أشباه الأفيونيات، مستويات الدوبامين المرتفعة في نظام المكافأة قد تلعب دوراً صغيراً فقط في الإدمان.[103] حين يمرّ الأفراد المدمنون للمنشطات عبر فترة الامتناع، فإنّهم لا يشعرون بالمعاناة الجسدية المصاحبة للامتناع عن الكحول أو الأفيون، وبدل ذلك يشعرون باشتهاء ورغبة شديدة للمخدّر يميّزها تهيّج وتململ وأعراض تيقّظ أخرى،[104] ناجمة عن إدمان نفسي.
يلعب نظام الدوبامين دوراً حاسماً في جوانب عدّة من الإدمان. في المرحلة المبكّرة، يمكن للفوارق الجينية التي تغيِّر التعبير عن مستقبلات الدوبامين في الدماغ التنبّؤُ بما إن كان الشخص سيجد المنشّطات جذابة أو منفّرة.[105] يُنتِج استهلاك المنشّطات زيادةً في مستويات الدوبامين في الدماغ تستمرّ من عدّة دقائق إلى ساعات.[96] أخيراً، تثير الزيادة المزمنة في الدوبامين التي تصاحب الاستهلاك المتكرّر لجرعات عالية من المنشّط مجموعةً متنوّعةً من التغيُّرات البنيوية في الدماغ والتي تكون مسؤولة عن السلوكيّات غير العادية التي تميّز الإدمان.[106] إنّ معالجة إدمان المنشّطات يحتاج إلى دعم ومساعدة، لأنه حتّى لو توقّف استهلاك المنشّط فإنّ الرغبة الشديدة المصاحبة للامتناع النفسي لا تتوقّف.[104] حتى حين يبدو أنّ الرغبة الشديدة قد اندثرت، يمكن أن تعاود الظهور عند مواجهة إلماعات ذات صلة بالعقار مثل: الأصدقاء والأماكن والحالات؛[104] إذ أنّ شبكات الترابط في الدماغ متشابكة بشكل كبير.[107]
الذهان والأدوية المضادّة للذهان
عدلاكتشف الأطباء النفسانيون في خمسينات القرن العشرين أنّ قسماً من العقاقير المعروفة بالمضادّات النمطية للذهان (المعروفة كذلك بالمهدّئات الكبرى) فعّآلة غالباً في تخفيض الأعراض النفسية الخاصّة بالفصام. أدّى إنتاج أوّل دواء مضادّ للذهان وهو كلوربرومازين (ثورازين) منتصف القرن العشرين إلى إطلاق سراح العديد من المرضى بالفصام من المصحّات في السنوات التي تلت إنتاجه. بحلول سبعينات القرن العشرين فهم العلماء أنّ هذه المضادّات النمطية للذهان تعمل كمناهضات لمستقبلات D2.[108] قاد هذا الفهم إلى ما يُزعم بأنه فرضية الدوبامين الخاصة بالفصام والتي تفترض أنّ السبب الرئيسي للفصام هو النشاط الفائق لأنظمة الدوبامين في الدماغ.[109] حصلت فرضية الدوبامين على دعم إضافي من ملاحظة أنّ الأعراض الذهانية كانت تزيد حدّتها عند تناول المنشّطات المحسِّنة لإنتاج الدوبامين مثل الميثامفيتامين، وأنّ هذه العقاقير يمكنها كذلك إحداث ذهان لدى الأشخاص الأصحّاء إن تمّ تناولها بجرعات كبيرة بالشكل الكافي.[109] خلال العقود اللاحقة في أواخر القرن العشرين تمّ تطوير مضادّات نمطية أخرى للذهان ذات أعراض جانبية خطيرة أقلّ. لا تعمل العديد من هذه الأدوية الجديدة مباشرة على مستقبلات الدوبامين، وبدل ذلك تُحدث تغييرات في نشاط الدوبامين بشكل غير مباشر.[110] استُخدمت هذه الأدوية كذلك لمعالجة ذهانات أخرى.[111] للأدوية المضادّة للذهان تأثيرُ تثبيطٍ واسع على معظم أنواع السلوك النشط وتُخفّض بشكل خاصّ سلوكَي الوهام والتهيّج المميِّزَين للذهان الصريح. رغم ذلك، لا يزال هناك خلاف كبير حول مقدار التحسّن الذي يشعر به المريض المتناوِل لهذه الأدوية.
تسبّبت ملاحظات لاحقة في فقدان فرضية الدوبامين لشعبيتها، على الأقلّ على هيئتها الأصلية البسيطة.[109] أحد الأسباب هو أنّ المرضى بالفصام لا يُظهِرون زيادة نمطية معتبرة في مستويات نشاط الدوبامين بالدماغ.[109] وربما أهمّ الأسباب هو أنّ تلك الأدوية التي تخفّض نشاط الدوبامين غير جيّدة إطلاقاً لمعالجة الفصام: فهي لا تخفّض سوى مجموعة فرعية من الأعراض، في حين أنّها تنتج آثاراً جانبية حادّة قصيرة وطويلة المدى. رغم ذلك، يستمرّ العديد من الأطبّاء النفسانيون وعلماء الأعصاب في الاعتقاد بأن سبب الفصام هو نوع من الاختلال الوظيفي لنظام الدوبامين. مع تطوّر فرضية الدوبامين بمرور الوقت أصبحت أنواع الاختلالات الوظيفية التي تفترضها تميل لأن تكون معقّدة وصعبة التمييز والإدراك.
الانتشار الواسع لاستخدام مضادّات الذهان مازال محلّ جدلٍ منذ فترة طويلة،[112] وتوجد عدّة أسباب لذلك: أوّلها أنّ المرضى المتناولين للأدوية المضادّة للذهان يعتبرونها مُكرِّهة جدّاً، لأنّها تسبب بلادة عامّة في الفِكر وتمنع القدرة على الشعور باللذّة والمتعة.[113] ثانيها أنّه من الصعب إظهار أنّها تعمل بشكل محدّد ضدّ سلوكيّات ذهانية بدل مجرّد كبت جميع أنواع السلوك النشط. ثالثها أنّها يمكن أن تُحدث آثاراً جانبية خطيرة تشمل زيادة الوزن والسكري واضطرابات جنسية وحدوث تغيّرات هرمونية، بالإضافة إلى إمكانية حدوث نوع خطير من اضطرابات الحركة يسمّى خلل الحركة المتأخر.[114] بعض هذه الآثار الجانبية يمكن أن يستمرّ لمدّة طويلة بعد التوقّف عن تناول الدواء، ويمكن حتّى أن تستمرّ بشكل دائم.
اضطراب نقص الانتباه مع فرط النشاط
عدلللانتقال العصبي المتغيّر دورٌ في اضطراب نقص الانتباه مع فرط النشاط (ADHD) وهو حالة تصاحبها وظائف تنفيذية معتلّة تؤدّي بدورها إلى مشاكل في تنظيم الانتباه (تحكم انتباهي) وتثبيط السلوكيّات (تحكم تثبيطي) ونسيان الأحداث أو عدم الانتباه للتفاصيل (ذاكرة عاملة) ومشاكل أخرى.[115] توجد صلات جينية بين مستقبلات الدوبامين وناقل الدوبامين والـADHD بالإضافة إلى صلات مع مستقبلات نواقل عصبية أخرى وناقلاتها.[116] العلاقة الأكثر أهمّية بين الدوبامين والـADHD تتضمّن العقاقير المستخدمة في علاجه.[117] بعض أكثر العوامل فعالية في علاج الـADHD هي المنشّطات النفسية مثل ميثيل فينيدات (ريتالين، كونسيرتا) وأمفيتامين (آديرال، ديكسيدرين)، والعقاقير التي تزيد مستويات كلٍّ من الدوبامين والنورإبينفرين في الدماغ.[117] التأثيرات السريرية لهذه المنشّطات النفسية في معالجة اضطراب نقص الانتباه مع فرط النشاط تتمّ عبر التفعيل غير المباشر لمستقبلات الدوبامين والنورإبينفرين، خاصّة مستقبل الدوبامين D1 والمستقبل الأدرينالي A2 في القشرة أمام الجبهية.[115][118][119]
الألم
عدليلعب الدوبامين دوراً في معالجة الألم في مناطق متعدّدة من الجهاز العصبي المركزي تشمل: النخاع الشوكي والسنجابية المحيطة بالمسال والمهاد والعقد القاعدية والقشرة الحزامية. لمستويات الدوبامين المنخفضة صلة بأعراض مؤلمة متواترة الحدوث في مرض باركنسون. تظهر الانتقالات العصبية دوبامينية الفعل غير الطبيعية في عدّة حالات سريرية مؤلمة منها: متلازمة الفم الحارق والألم العضلي الليفي ومتلازمة تململ الساقين.[120]
الغثيان
عدليُحدَّد الغثيان والتقيؤ بشكل كبير بالنشاط في الباحة المنخفضة في بصلة جذع الدماغ بمنطقة تعرف باسم منطقة حث المستقبل الكيميائي.[121] تحتوي هذه المنطقة على كمية كبيرة من مستقبلات الدوبامين D2. وكنتيجة لذلك، تكون لدى العقاقير التي تنشّط مستقبلات D2 إمكانية عالية لإحداث الغثيان. تشمل مجموعة العقاقير هذه بعض الأدوية التي توصف لمرض باركنسون وكذلك بعض ناهضات الدوبامين مثل الآبومورفين.[122] في بعض الحالات، مناهضات المستقبل D2 مثل ميتوكلوبراميد مفيدة للاستعمال كمضادات للقيء.
علم الأحياء المقارن
عدلالأحياء الدقيقة
عدللا توجد تقارير على وجود الدوبامين في البكتريا العتيقة، ولكنّه اكتشف في بعض أنواع البكتريا وفي بعض الكائنات الأولية مثل رباعية الغشاء.[123] ومن جهة أخرى، تحوي بعض أنواع البكتريا على كافّة الإنزيمات المشابهة بالنسق للإنزيمات التي تستخدمها الحيوانات لاصطناع الدوبامين.[124] جرى اقتراح أنّ الحيوانات حصلت على آلية اصطناع الدوبامين من البكتريا عن طريق نقل الجينات الأفقي، الذي يمكن أن يكون قد حصل بوقت متأخّر نسبياً قياساً على زمن التطوّر، وربّما يعود ذلك نتيجةً للتضمين التعايشي التكافلي للبكتريا في خلايا حقيقيات النوى الذي أدّى إلى نشوء المتقدرات (الميتوكندريون).[124]
الحيوانات
عدليُستخدم الدوبامين ناقلاً عصبياً في معظم الحيوانات متعدّدة الخلايا.[125] ففي الإسفنجيات بيّّنَ تقرير واحد على وجود الدوبامين، من غير الدلالة على دوره الوظيفي؛[126] إلّا أنّه بالمقابل توجد عدّة تقارير على وجود الدوبامين في الجهاز العصبي للعديد من الأنواع الأخرى، ومن ضمنها قنديل البحر اللاسع والهيدرا والمرجان.[127] يشير هذا الأمر إلى أنّ ظهور الدوبامين ضمن النواقل العصبية يعود إلى أقدم أشكال الجهاز العصبي، وذلك تقديرياً إلى أكثر من نحو 500 مليون سنة في العصر الكامبري.
يؤدّي الدوبامين دورَ الناقل العصبي في الفقاريات وشوكيات الجلد ومفصليات الأرجل والرخويات والعديد من أنواع الديدان.[128][129] يقوم الدوبامين في أنواع الحيوانات التي تحويه بتعديل أو تحوير السلوك الحركي.[125] وفي عددٍ من الدراسات على النماذج الحية وُجد أنّ الدوبامين يقلّل من حركة الربداء الرشيقة، وهي نوع من أنواع الديدان الأسطوانية، لكنّه يزيد من الحركات الباحثة عن الغذاء؛ أمّا في الديدان المسطّحة فيعمل الدوبامين على زيادة الحركات اللولبية؛ أمّا في العلقيات فهو يثبّط من السباحة، لكنّه يحفّز الزحف. أمّا في الفقاريات فهو يقوم في أغلبها بدور منشّط وله تأثير على تبدّل السلوك وانتقاء التجاوب، وذلك بشكل مماثل لتأثيره في الثدييات.[125] وُجد أيضاً أنّ للدوبامين في جميع مجموعات الحيوانات دورٌ في التعلّم بأسلوب المكافأة؛[125] وهذه الملاحظة تنسحب أيضاً على بعض أنواع اللافقاريات مثل الديدان والرخويات ومفصليات الأرجل مثل ذبابة الفاكهة الشائعة، والتي يمكن أن تُدرَّب لتكرِّرَ فعلاً ما، إذا كان متبوعاً بشكلٍ متّسقٍ بزيادة مستويات الدوبامين.[125] كان يُظن في البداية أن مفصليات الأرجل تمثل استثناءً لأثر الدوبامين على مملكة الحيوانات، إذ وجد البعض أنه يعطي معها مفعولاً عكسياً، وأنّ نظام المكافأة كان يفعّل بواسطة الأكتوبامين، وهو ناقل عصبي ذي صلة بالنورإبينفرين؛[130] إلّا أنّ الدراسات الأخيرة على ذبابة الفاكهة بيّنت أنّ للدوبامين بالفعل دور بالتعلّم وفق نظام المكافأة، وأن التحفيز باستخدام الأكتوبامين يعود إلى تنشيط العصبونات الدوبامينية.[130]
النباتات
عدلتقوم أنواعٌ مختلفة من النباتات باصطناع الدوبامين بدرجات مختلفة. وُجد أعلى تركيز لهذه المادّة في الموز الأحمر والأصفر بمستويات تتراوح بين 40 إلى 50 جزء في المليون وزناً. عُثرَ على تراكيز من الدوبامين بحوالي جزء واحد في المليون أو أكثر بقليل في كلّ من البطاطا والأفوكادو والقنبيط الأخضر وكرنب بروكسل؛ بالمقابل فإنّ البرتقال والطماطم والسبانخ والفاصولياء وعدد من النباتات الأخرى تحوي مستويات من الدوبامين قابلة للقياس وتبلغ أقلّ من جزء واحد في المليون.[131] يُصطنَع الدوبامين في النباتات انطلاقاً من الحمض الأميني تيروسين، وذلك وفق آلية كيميائية حيوية شبيهة لما تجري في مملكة الحيوانات. لم تتضّح الصورة بعد بالنسبة لدور الدوبامين في النباتات، لكن توجد دلائل أنّه يلعب دوراً في الاستجابة للعوامل المجهدة مثل العدوى البكترية، كما يقوم بدور عامل محفّز للنموّ في بعض الحالات، كما يقوم بتحوير وتعديل أسلوب استقلاب السكريات. رغم ذلك، فإنّ المستقبلات التي تتوسّط القيام بهذه الأفعال لم تحدّد بعد، لا هي ولا الآليات بين الخلوية التي تنشّطها. تُستقلَب هذه المادة في النباتات بعدّة طرق بشكل ينتج الميلانين وعددٍ مختلف من أشباه القلويات كمنتجات ثانوية. تعدّ مركّبات الميلانين من المواد الصباغية الداكنة، والتي توجد في عددٍ كبير من أطياف الكائنات الحية، وهي قريبة من حيث البنية الكيميائية من الدوبامين؛ كما يوجد نوع من الميلانين يعرف باسم «دوبامين-ميلانين» والذي يمكن اصطناعه من أكسدة الدوبامين بواسطة إنزيم تيروسيناز.[132] يَستخدم بعض الدوبامين في النباتات غالباً مادّةً بادئة في اصطناع دوبامين-ميلانين.[133] هناك دلائل على وجود مادة دوبامين-ميلانين في الحيوانات. يعتقد أنّ الزخارف المعقّدة على أجنحة الفراشات، وكذلك التخطيطات ذات اللونين الأبيض والأسود الموجودة على أجسام بعض يرقات الحشرات، هي ناتجة عن تراكمات بنيوية مهيكلة من مركّب دوبامين-ميلانين.[134] لا ينتمي الميلانين الموجود في جسم الإنسان والمسؤول عن تدكين لون البشرة إلى الصنف المذكور آنفاً، إذ أنّه يُصطنع في الجسم عبر مسار يستخدم ليفودوبا مادّةً بادئة وليس الدوبامين. بالرغم من ذلك، فإنّ هناك دلائل تشير إلى أنّ الميلانين العصبي الذي يسبّب لون المادة السوداء في الدماغ، قد يكون، ولو بجزء منه على الأقل، مؤلّفاً من دوبامين-ميلانين.[135]
لا يؤثّر الدوبامين المستهلك غذائياً على الدماغ، لأنّه لا يقدر على عبور الحاجز الدموي الدماغي؛[23] إلّا أنّ هناك العديد من النباتات الحاوية على ليفودوبا، وهو طليعة الدوبامين الاستقلابية،[136] ووُجدت أعلى تراكيز منها في نبتة الميقونة، وخاصّة الميقونة الشهوانية (الاسم العلمي: Mucuna pruriens)، والتي تستخدم مصدراً لها في صناعة العقاقير.[137] كما عثر على مستويات مرتفعة من ليفودوبا في نبات الفول، وذلك بشكل أكبر في القشور والأجزاء الأخرى من النبتة بالمقارنة مع الحبوب.[138] وجد أيضاً أن بذور أشجار السنا والبوهينيا تحوي كمّيات معتبرة من الليفودوبا.
تاريخ الأبحاث
عدلاصطُنِع الدوبامين لأوّل مرّة سنة 1910 من الكيميائي جورج بارغر وزميله جيمس إونز [ملاحظة 9] في مختبرات ويلكم في لندن؛[139] وسُمّي بهذا الاسم للإشارة إلى بنيته الكيميائية، إذ أنّ المركّب يُستحصَل من سلفه المركّب الطليعي ثنائي هيدروكسي فينيل ألانين dihydroxyphenylalanine والذي يرمز له اختصاراً DOPA؛ كما أنّ الدوبامين يحوي مجموعة أمين وظيفية، وبذلك يصبح الاسم بالكامل دوبامين.
اكتشف العالم السويدي أرفيد كارلسون ومساعديه دور الدوبامين الوظيفي في النقل العصبي في الدماغ سنة 1958؛[140] وحاز بسبب هذا الاكتشاف على جائزة نوبل في علم وظائف الأعضاء سنة 2000، إذ بيَّنَ كارلسون أنّ الدوبامين ليس مجرّد مركّب وسطي في اصطناع النورإبينفرين، ولكنّه ناقل عصبي أيضاً.[141]
بولي دوبامين
عدلوجدت بعض الأبحاث سنة 2007 أنّ وضع العديد من المواد في محلول متوسّط القلوية من الدوبامين سيؤدّي إلى تغطيتها بطبقة من الدوبامين المتبلمر، والذي أشير إليه باسم بولي دوبامين.[142][143] يُستحصل على هذا الشكل المبلمر من الدوبامين من تفاعل أكسدة تلقائية، وهو بنيوياً يعدّ نوعاً من الميلانين.[144] يمكن اصطناع بولي دوبامين من تفاعل ملح هيدروكلوريد الدوبامين مع مركّب تريس القاعدي في الماء؛ ولا تزال بنية الشكل البوليميري من الدوبامين غير معروفة. يتشكّل غطاء من طبقة البولي دوبامين على الأجسام المغموسة في محلول التحضير، وهي يمكن أن تتفاوت في حجمها من الجسيمات النانوية إلى الأسطح الكبيرة. لا تزال الأبحاث مستمرّة في إيجاد تطبيقات مناسبة لهذه المادة، ومن ضمن الاقتراحات استخدامها في تغليف الأدوية؛ أو استغلال خواصّها اللاصقة كركيزة في المستشعرات الحيوية.
انظر أيضًا
عدلهوامش
عدل- ^ يرمز له اختصاراً DA وذلك من التسمية الكيميائية النظامية dihydroxyphenethylamine: ثنائي هيدروكسي فينئيثيلامين
- ^ Annica Dahlström وKjell Fuxe
- ^ بالإنجليزية wanting وتعني الابتغاء أو الإرادة
- ^ بالإنجليزية desire وتعني الرغبة أو التوق
- ^ بالإنجليزية seeking وتعني السعي للحصول على أو نشد (الأمر).
- ^ بالإنجليزية liking وتعني الإعجاب أو المحبة.
- ^ بالإنجليزية pleasure وتعني المتعة أو اللذة.
- ^ Wolfram Schultz
- ^ James Ewens
مراجع
عدل- ^ ا ب Simon Maskell; Munir Pirmohamed (4 Mar 2022). "A reference set of clinically relevant adverse drug-drug interactions". Scientific Data (بالإنجليزية). 9 (1). DOI:10.1038/S41597-022-01159-Y. ISSN:2052-4463. QID:Q123478206.
- ^ ا ب ج د "Dopamine: Biological activity". IUPHAR/BPS guide to pharmacology. International Union of Basic and Clinical Pharmacology. مؤرشف من الأصل في 2018-09-16. اطلع عليه بتاريخ 2016-01-29.
- ^ ا ب ج د dopamine (بالإنجليزية), QID:Q278487
- ^ dopamine، QID:Q2311683
- ^ dopamine، معهد المعلوماتية الحيوية الأوروبي، QID:Q902623
- ^ DOPAMINE، QID:Q6120337
- ^ ا ب ج د ه و ز ح Malenka RC، Nestler EJ، Hyman SE (2009). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (ط. 2nd). New York: McGraw-Hill Medical. ص. 147–48, 366–67, 375–76. ISBN:978-0-07-148127-4.
- ^ Baliki MN، Mansour A، Baria AT، Huang L، Berger SE، Fields HL، Apkarian AV (أكتوبر 2013). "Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain". The Journal of Neuroscience. ج. 33 ع. 41: 16383–93. DOI:10.1523/JNEUROSCI.1731-13.2013. PMC:3792469. PMID:24107968.
- ^ ا ب Wenzel JM، Rauscher NA، Cheer JF، Oleson EB (يناير 2015). "A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature". ACS Chemical Neuroscience. ج. 6 ع. 1: 16–26. DOI:10.1021/cn500255p. PMC:5820768. PMID:25491156.
- ^ Puglisi-Allegra S، Ventura R (يونيو 2012). "Prefrontal/accumbal catecholamine system processes high motivational salience". Front. Behav. Neurosci. ج. 6: 31. DOI:10.3389/fnbeh.2012.00031. PMC:3384081. PMID:22754514.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Volkow ND، Wang GJ، Kollins SH، Wigal TL، Newcorn JH، Telang F، Fowler JS، Zhu W، Logan J، Ma Y، Pradhan K، Wong C، Swanson JM (سبتمبر 2009). "Evaluating dopamine reward pathway in ADHD: clinical implications". JAMA. ج. 302 ع. 10: 1084–91. DOI:10.1001/jama.2009.1308. PMC:2958516. PMID:19738093.
- ^ Moncrieff J (2008). The myth of the chemical cure. A critique of psychiatric drug treatment. Basingstoke, UK: Palgrave MacMillan. ISBN:978-0-230-57432-8.
- ^ "Dopamine". PubChem. مؤرشف من الأصل في 2019-08-03. اطلع عليه بتاريخ 2015-09-21.
- ^ "Catecholamine". Britannica. مؤرشف من الأصل في 2019-08-05. اطلع عليه بتاريخ 2015-09-21.
- ^ "Phenylethylamine". ChemicalLand21.com. مؤرشف من الأصل في 2018-09-16. اطلع عليه بتاريخ 2015-09-21.
- ^ Carter JE، Johnson JH، Baaske DM (1982). "Dopamine Hydrochloride". Analytical Profiles of Drug Substances. ج. 11: 257–72. DOI:10.1016/S0099-5428(08)60266-X. ISBN:9780122608117.
- ^ Broadley KJ (مارس 2010). "The vascular effects of trace amines and amphetamines". Pharmacol. Ther. ج. 125 ع. 3: 363–375. DOI:10.1016/j.pharmthera.2009.11.005. PMID:19948186.
- ^ Lindemann L، Hoener MC (مايو 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends Pharmacol. Sci. ج. 26 ع. 5: 274–281. DOI:10.1016/j.tips.2005.03.007. PMID:15860375.
- ^ Wang X، Li J، Dong G، Yue J (فبراير 2014). "The endogenous substrates of brain CYP2D". Eur. J. Pharmacol. ج. 724: 211–218. DOI:10.1016/j.ejphar.2013.12.025. PMID:24374199.
- ^ EC 1.14.16.2 – Tyrosine 3-monooxygenase (Homo sapiens). Technische Universität Braunschweig. يوليو 2016. مؤرشف من الأصل في 2020-08-03. اطلع عليه بتاريخ 2016-10-07.
Substrate: L-phenylalanine + tetrahydrobiopterin + O2
Product: L-tyrosine + 3-hydroxyphenylalanine [(aka m-tyrosine)] + dihydropteridine + H2O
Organism: Homo sapiens{{استشهاد بموسوعة}}:|موقع=تُجوهل (مساعدة)
Reaction diagram نسخة محفوظة 14 يوليو 2017 على موقع واي باك مشين. - ^ EC 4.1.1.28 – Aromatic-L-amino-acid decarboxylase (Homo sapiens). Technische Universität Braunschweig. يوليو 2016. مؤرشف من الأصل في 2020-12-08. اطلع عليه بتاريخ 2016-10-07.
Substrate: m-tyrosine
Product: m-tyramine + CO2
Organism: Homo sapiens{{استشهاد بموسوعة}}:|موقع=تُجوهل (مساعدة)
Reaction diagram نسخة محفوظة 4 مارس 2016 على موقع واي باك مشين. - ^ ا ب ج د ه و ز ح ط ي Musacchio JM (2013). "Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines". Biochemistry of Biogenic Amines. Springer. ص. 1–35. ISBN:978-1-4684-3171-1.
- ^ ا ب ج د ه و ز ح ط ي يا The National Collaborating Centre for Chronic Conditions، المحرر (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. ص. 59–100. ISBN:978-1-86016-283-1. مؤرشف من الأصل في 2010-09-24. اطلع عليه بتاريخ 2015-09-24.
- ^ ا ب ج د ه و ز ح ط ي يا Eisenhofer G، Kopin IJ، Goldstein DS (سبتمبر 2004). "Catecholamine metabolism: a contemporary view with implications for physiology and medicine". Pharmacological Reviews. ج. 56 ع. 3: 331–49. DOI:10.1124/pr.56.3.1. PMID:15317907.
- ^ Amin F، Davidson M، Davis KL (1992). "Homovanillic acid measurement in clinical research: a review of methodology". Schizophrenia Bulletin. ج. 18 ع. 1: 123–48. DOI:10.1093/schbul/18.1.123. PMID:1553492. مؤرشف من الأصل في 2020-04-24.
- ^ Amin F، Davidson M، Kahn RS، Schmeidler J، Stern R، Knott PJ، Apter S (1995). "Assessment of the central dopaminergic index of plasma HVA in schizophrenia". Schizophrenia Bulletin. ج. 21 ع. 1: 53–66. DOI:10.1093/schbul/21.1.53. PMID:7770741.
- ^ Sulzer D، Zecca L (فبراير 2000). "Intraneuronal dopamine-quinone synthesis: a review". Neurotoxicity Research. ج. 1 ع. 3: 181–95. DOI:10.1007/BF03033289. PMID:12835101.
- ^ Miyazaki I، Asanuma M (يونيو 2008). "Dopaminergic neuron-specific oxidative stress caused by dopamine itself" (PDF). Acta Medica Okayama. ج. 62 ع. 3: 141–50. DOI:10.18926/AMO/30942. PMID:18596830. مؤرشف من الأصل (PDF) في 2018-09-16.
- ^ ا ب ج د ه Grandy DK، Miller GM، Li JX (فبراير 2016). ""TAARgeting Addiction" – The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence. ج. 159: 9–16. DOI:10.1016/j.drugalcdep.2015.11.014. PMC:4724540. PMID:26644139.
TAAR1 is a high-affinity receptor for METH/AMPH and DA
- ^ Seeman P (2009). "Chapter 1: Historical overview: Introduction to the dopamine receptors". The Dopamine Receptors. Springer. ص. 1–22. ISBN:978-1-60327-333-6.
- ^ ا ب ج د Romanelli RJ، Williams JT، Neve KA (2009). "Chapter 6: Dopamine receptor signalling: intracellular pathways to behavior". The Dopamine Receptors. Springer. ص. 137–74. ISBN:978-1-60327-333-6.
- ^ Eiden LE، Schäfer MK، Weihe E، Schütz B (فبراير 2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv. ج. 447 ع. 5: 636–40. DOI:10.1007/s00424-003-1100-5. PMID:12827358.
- ^ ا ب Miller GM (يناير 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". Journal of Neurochemistry. ج. 116 ع. 2: 164–76. Bibcode:2006JNeur..26.9606G. DOI:10.1111/j.1471-4159.2010.07109.x. PMC:3005101. PMID:21073468.
- ^ ا ب Beaulieu JM، Gainetdinov RR (مارس 2011). "The physiology, signaling, and pharmacology of dopamine receptors". Pharmacological Reviews. ج. 63 ع. 1: 182–217. DOI:10.1124/pr.110.002642. PMID:21303898.
- ^ Torres GE، Gainetdinov RR، Caron MG (يناير 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Nature Reviews. Neuroscience. ج. 4 ع. 1: 13–25. DOI:10.1038/nrn1008. PMID:12511858.
- ^ ا ب ج د Rice ME، Patel JC، Cragg SJ (ديسمبر 2011). "Dopamine release in the basal ganglia". Neuroscience. ج. 198: 112–37. DOI:10.1016/j.neuroscience.2011.08.066. PMC:3357127. PMID:21939738.
- ^ Schultz W (2007). "Multiple dopamine functions at different time courses". Annual Review of Neuroscience. ج. 30: 259–88. DOI:10.1146/annurev.neuro.28.061604.135722. PMID:17600522.
- ^ ا ب ج د ه و ز ح Björklund A، Dunnett SB (مايو 2007). "Dopamine neuron systems in the brain: an update". Trends in Neurosciences. ج. 30 ع. 5: 194–202. DOI:10.1016/j.tins.2007.03.006. PMID:17408759.
- ^ Dahlstroem A، Fuxe K (1964). "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons". Acta Physiologica Scandinavica. Supplementum. ج. 232: SUPPL 232:1–55. PMID:14229500.
- ^ ا ب ج د Malenka RC، Nestler EJ، Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (ط. 2nd). New York: McGraw-Hill Medical. ص. 147–48, 154–57. ISBN:978-0-07-148127-4.
- ^ Christine CW، Aminoff MJ (سبتمبر 2004). "Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance". The American Journal of Medicine. ج. 117 ع. 6: 412–19. DOI:10.1016/j.amjmed.2004.03.032. PMID:15380498.
- ^ Paulus W، Schomburg ED (يونيو 2006). "Dopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?". Sleep Medicine Reviews. ج. 10 ع. 3: 185–96. DOI:10.1016/j.smrv.2006.01.004. PMID:16762808.
- ^ Ben-Jonathan N، Hnasko R (ديسمبر 2001). "Dopamine as a prolactin (PRL) inhibitor". Endocrine Reviews. ج. 22 ع. 6: 724–63. DOI:10.1210/er.22.6.724. PMID:11739329.
- ^ ا ب ج د Witkovsky P (يناير 2004). "Dopamine and retinal function". Documenta Ophthalmologica. Advances in Ophthalmology. ج. 108 ع. 1: 17–40. DOI:10.1023/B:DOOP.0000019487.88486.0a. PMID:15104164. مؤرشف من الأصل في 2020-01-09.
- ^ ا ب Fix JD (2008). "Basal Ganglia and the Striatal Motor System". Neuroanatomy (Board Review Series) (ط. 4th). Baltimore: Wulters Kluwer & Lippincott Wiliams & Wilkins. ص. 274–81. ISBN:978-0-7817-7245-7. مؤرشف من الأصل في 2020-07-31.
- ^ ا ب ج د ه و Chakravarthy VS، Joseph D، Bapi RS (سبتمبر 2010). "What do the basal ganglia do? A modeling perspective". Biological Cybernetics. ج. 103 ع. 3: 237–53. DOI:10.1007/s00422-010-0401-y. PMID:20644953. مؤرشف من الأصل في 2018-09-19.
- ^ ا ب ج د Floresco SB (يناير 2015). "The nucleus accumbens: an interface between cognition, emotion, and action". Annual Review of Psychology. ج. 66: 25–52. DOI:10.1146/annurev-psych-010213-115159. PMID:25251489. مؤرشف من الأصل في 2020-04-24.
- ^ Balleine BW، Dezfouli A، Ito M، Doya K (2015). "Hierarchical control of goal-directed action in the cortical–basal ganglia network". Current Opinion in Behavioral Sciences. ج. 5: 1–7. DOI:10.1016/j.cobeha.2015.06.001.
- ^ ا ب ج Jankovic J (أبريل 2008). "Parkinson's disease: clinical features and diagnosis". Journal of Neurology, Neurosurgery, and Psychiatry. ج. 79 ع. 4: 368–76. DOI:10.1136/jnnp.2007.131045. PMID:18344392. مؤرشف من الأصل في 2019-07-03.
- ^ Pattij T، Vanderschuren LJ (أبريل 2008). "The neuropharmacology of impulsive behaviour". Trends in Pharmacological Sciences. ج. 29 ع. 4: 192–99. DOI:10.1016/j.tips.2008.01.002. PMID:18304658. مؤرشف من الأصل في 2018-09-19.
- ^ ا ب ج د ه و ز ح ط ي يا يب Schultz W (يوليو 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Physiological Reviews. ج. 95 ع. 3: 853–951. DOI:10.1152/physrev.00023.2014. PMC:4491543. PMID:26109341.
- ^ Robinson TE، Berridge KC (1993). "The neural basis of drug craving: an incentive-sensitization theory of addiction". Brain Research. Brain Research Reviews. ج. 18 ع. 3: 247–91. DOI:10.1016/0165-0173(93)90013-p. hdl:2027.42/30601. PMID:8401595.
- ^ Wright JS، Panksepp J (2012). "An evolutionary framework to understand foraging, wanting, and desire: the neuropsychology of the SEEKING system". Neuropsychoanalysis. ج. 14 ع. 1: 5–39. DOI:10.1080/15294145.2012.10773683. مؤرشف من الأصل في 2020-04-24. اطلع عليه بتاريخ 2015-09-24.
- ^ ا ب ج د ه Berridge KC، Robinson TE، Aldridge JW (فبراير 2009). "Dissecting components of reward: 'liking', 'wanting', and learning". Current Opinion in Pharmacology. ج. 9 ع. 1: 65–73. DOI:10.1016/j.coph.2008.12.014. PMC:2756052. PMID:19162544.
- ^ Bromberg-Martin ES، Matsumoto M، Hikosaka O (ديسمبر 2010). "Dopamine in motivational control: rewarding, aversive, and alerting". Neuron. ج. 68 ع. 5: 815–34. DOI:10.1016/j.neuron.2010.11.022. PMC:3032992. PMID:21144997.
- ^ Yager LM، Garcia AF، Wunsch AM، Ferguson SM (أغسطس 2015). "The ins and outs of the striatum: Role in drug addiction". Neuroscience. ج. 301: 529–41. DOI:10.1016/j.neuroscience.2015.06.033. PMC:4523218. PMID:26116518.
- ^ ا ب Saddoris MP، Cacciapaglia F، Wightman RM، Carelli RM (أغسطس 2015). "Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation". The Journal of Neuroscience. ج. 35 ع. 33: 11572–82. DOI:10.1523/JNEUROSCI.2344-15.2015. PMC:4540796. PMID:26290234.
- ^ Berridge KC، Kringelbach ML (مايو 2015). "Pleasure systems in the brain". Neuron. ج. 86 ع. 3: 646–64. DOI:10.1016/j.neuron.2015.02.018. PMC:4425246. PMID:25950633.
- ^ Wise RA (أكتوبر 2008). "Dopamine and reward: the anhedonia hypothesis 30 years on". Neurotoxicity Research. ج. 14 ع. 2–3: 169–83. DOI:10.1007/BF03033808. PMC:3155128. PMID:19073424.
- ^ Arias-Carrión O، Pöppel E (2007). "Dopamine, learning and reward-seeking behavior". Acta Neurobiol Exp. ج. 67 ع. 4: 481–88.
- ^ Wise RA (1996). "Addictive drugs and brain stimulation reward". Annual Review of Neuroscience. ج. 19: 319–40. DOI:10.1146/annurev.ne.19.030196.001535. PMID:8833446.
- ^ Salamone JD، Correa M، Mingote S، Weber SM (أبريل 2003). "Nucleus accumbens dopamine and the regulation of effort in food-seeking behavior: implications for studies of natural motivation, psychiatry, and drug abuse". The Journal of Pharmacology and Experimental Therapeutics. ج. 305 ع. 1: 1–8. DOI:10.1124/jpet.102.035063. PMID:12649346. مؤرشف من الأصل في 2018-09-19.
- ^ ا ب Ferreri L، Mas-Herrero E، Zatorre RJ، Ripollés P، Gomez-Andres A، Alicart H، Olivé G، Marco-Pallarés J، Antonijoan RM، Valle M، Riba J، Rodriguez-Fornells A (يناير 2019). "Dopamine modulates the reward experiences elicited by music". Proceedings of the National Academy of Sciences of the United States of America. ج. 116 ع. 9: 3793–3798. DOI:10.1073/pnas.1811878116. PMC:6397525. PMID:30670642.
- ^ ا ب Goupil L، Aucouturier JJ (فبراير 2019). "Musical pleasure and musical emotions". Proceedings of the National Academy of Sciences of the United States of America. ج. 116 ع. 9: 3364–3366. DOI:10.1073/pnas.1900369116. PMC:6397567. PMID:30770455.
- ^ Missale C، Nash SR، Robinson SW، Jaber M، Caron MG (يناير 1998). "Dopamine receptors: from structure to function". Physiological Reviews. ج. 78 ع. 1: 189–225. DOI:10.1152/physrev.1998.78.1.189. PMID:9457173.
- ^ ا ب Buttarelli FR، Fanciulli A، Pellicano C، Pontieri FE (يونيو 2011). "The dopaminergic system in peripheral blood lymphocytes: from physiology to pharmacology and potential applications to neuropsychiatric disorders". Current Neuropharmacology. ج. 9 ع. 2: 278–88. DOI:10.2174/157015911795596612. PMC:3131719. PMID:22131937.
- ^ ا ب Sarkar C، Basu B، Chakroborty D، Dasgupta PS، Basu S (مايو 2010). "The immunoregulatory role of dopamine: an update". Brain, Behavior, and Immunity. ج. 24 ع. 4: 525–28. DOI:10.1016/j.bbi.2009.10.015. PMC:2856781. PMID:19896530.
- ^ Hussain T، Lokhandwala MF (فبراير 2003). "Renal dopamine receptors and hypertension". Experimental Biology and Medicine. ج. 228 ع. 2: 134–42. DOI:10.1177/153537020322800202. PMID:12563019.
- ^ Choi MR، Kouyoumdzian NM، Rukavina Mikusic NL، Kravetz MC، Rosón MI، Rodríguez Fermepin M، Fernández BE (مايو 2015). "Renal dopaminergic system: Pathophysiological implications and clinical perspectives". World Journal of Nephrology. ج. 4 ع. 2: 196–212. DOI:10.5527/wjn.v4.i2.196. PMC:4419129. PMID:25949933.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Carey RM (سبتمبر 2001). "Theodore Cooper Lecture: Renal dopamine system: paracrine regulator of sodium homeostasis and blood pressure". Hypertension. ج. 38 ع. 3: 297–302. DOI:10.1161/hy0901.096422. PMID:11566894.
- ^ Rubí B، Maechler P (ديسمبر 2010). "Minireview: new roles for peripheral dopamine on metabolic control and tumor growth: let's seek the balance". Endocrinology. ج. 151 ع. 12: 5570–81. DOI:10.1210/en.2010-0745. PMID:21047943. مؤرشف من الأصل في 24 أبريل 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ "WHO Model List of Essential Medicines" (PDF). World Health Organization. أكتوبر 2013. مؤرشف من الأصل في 2018-03-05. اطلع عليه بتاريخ 2015-09-24.
- ^ Noori S، Friedlich P، Seri I (2003). "Pharmacology Review Developmentally Regulated Cardiovascular, Renal, and Neuroendocrine Effects of Dopamine". NeoReviews. ج. 4 ع. 10: e283–e288. DOI:10.1542/neo.4-10-e283. مؤرشف من الأصل في 2018-09-19. اطلع عليه بتاريخ 2015-09-24.
- ^ Bhatt-Mehta V، Nahata MC (1989). "Dopamine and dobutamine in pediatric therapy". Pharmacotherapy. ج. 9 ع. 5: 303–14. DOI:10.1002/j.1875-9114.1989.tb04142.x. PMID:2682552.
- ^ ا ب Bronwen JB، Knights KM (2009). Pharmacology for Health Professionals (ط. 2nd). Elsevier Australia. ص. 192. ISBN:978-0-7295-3929-6.
- ^ De Backer D، Biston P، Devriendt J، Madl C، Chochrad D، Aldecoa C، Brasseur A، Defrance P، Gottignies P، Vincent JL (مارس 2010). "Comparison of dopamine and norepinephrine in the treatment of shock". The New England Journal of Medicine. ج. 362 ع. 9: 779–89. DOI:10.1056/NEJMoa0907118. PMID:20200382.
- ^ Karthik S، Lisbon A (2006). "Low-dose dopamine in the intensive care unit". Seminars in Dialysis. ج. 19 ع. 6: 465–71. DOI:10.1111/j.1525-139X.2006.00208.x. PMID:17150046.
- ^ Moses، Scott. "Dopamine". Family Practice Notebook. مؤرشف من الأصل في 2018-10-24. اطلع عليه بتاريخ 2016-02-01.
- ^ Katritsis، Demosthenes G.؛ Gersh، Bernard J.؛ Camm، A. John (19 سبتمبر 2013). Clinical Cardiology: Current Practice Guidelines. OUP Oxford. ISBN:978-0-19-150851-6. مؤرشف من الأصل في 2016-12-31.
Dopamine binds to beta-1, beta-2, alpha-1 and dopaminergic receptors
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Lewis RJ (2004). Sax's Dangerous Properties of Industrial Materials (ط. 11th). Hoboken, NJ.: Wiley & Sons. ص. 1552. ISBN:978-0-471-47662-7.
- ^ Deng WP، Wong KA، Kirk KL (2002). "Convenient syntheses of 2-, 5- and 6-fluoro- and 2,6-difluoro-L-DOPA". Tetrahedron: Asymmetry. ج. 13 ع. 11: 1135–40. DOI:10.1016/S0957-4166(02)00321-X.
- ^ Standaert DG، Walsh RR (2011). "Pharmacology of dopaminergic neurotransmission". Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy. Lippincott Williams & Wilkins. ص. 186–206. ISBN:978-1-4511-1805-6.
- ^ Mobbs، Charles V.؛ Hof، Patrick R. (2009). Handbook of the neuroscience of aging. Amsterdam: Elsevier/Academic Press. ISBN:978-0-12-374898-0. OCLC:299710911.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Ota M، Yasuno F، Ito H، Seki C، Nozaki S، Asada T، Suhara T (يوليو 2006). "Age-related decline of dopamine synthesis in the living human brain measured by positron emission tomography with L-[beta-11C]DOPA". Life Sciences. ج. 79 ع. 8: 730–36. DOI:10.1016/j.lfs.2006.02.017. PMID:16580023.
- ^ Kaasinen V، Vilkman H، Hietala J، Någren K، Helenius H، Olsson H، Farde L، Rinne J (2000). "Age-related dopamine D2/D3 receptor loss in extrastriatal regions of the human brain". Neurobiology of Aging. ج. 21 ع. 5: 683–68. DOI:10.1016/S0197-4580(00)00149-4. PMID:11016537.
- ^ Wang Y، Chan GL، Holden JE، Dobko T، Mak E، Schulzer M، Huser JM، Snow BJ، Ruth TJ، Calne DB، Stoessl AJ (سبتمبر 1998). "Age-dependent decline of dopamine D1 receptors in human brain: a PET study". Synapse. ج. 30 ع. 1: 56–61. DOI:10.1002/(SICI)1098-2396(199809)30:1<56::AID-SYN7>3.0.CO;2-J. PMID:9704881.
- ^ ا ب Wong DF، Wagner HN، Dannals RF، Links JM، Frost JJ، Ravert HT، Wilson AA، Rosenbaum AE، Gjedde A، Douglass KH (ديسمبر 1984). "Effects of age on dopamine and serotonin receptors measured by positron tomography in the living human brain". Science. ج. 226 ع. 4681: 1393–96. Bibcode:1984Sci...226.1393W. DOI:10.1126/science.6334363. PMID:6334363.
- ^ ا ب Wang، E.؛ Snyder، S.D. (1998). Handbook of the aging brain. San Diego, California: Academic Press. ISBN:978-0-12-734610-6. OCLC:636693117.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Chang L، Jiang CS، Ernst T (يناير 2009). "Effects of age and sex on brain glutamate and other metabolites". Magnetic Resonance Imaging. ج. 27 ع. 1: 142–45. DOI:10.1016/j.mri.2008.06.002. PMC:3164853. PMID:18687554.
- ^ Dobryakova، Ekaterina؛ Genova، Helen M.؛ DeLuca، John؛ Wylie، Glenn R. (12 مارس 2015). "The Dopamine Imbalance Hypothesis of Fatigue in Multiple Sclerosis and Other Neurological Disorders". Frontiers in Neurology. ج. 6. DOI:10.3389/fneur.2015.00052.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Marino، Franca؛ Cosentino، Marco (29 مارس 2016). "Repurposing dopaminergic drugs for MS — the evidence mounts". Nature Reviews Neurology. ج. 12 ع. 4: 191–192. DOI:10.1038/nrneurol.2016.33.
- ^ Dickson DV (2007). "Neuropathology of movement disorders". Parkinson's disease and movement disorders. Hagerstown, MD: Lippincott Williams & Wilkins. ص. 271–83. ISBN:978-0-7817-7881-7.
- ^ Tuite PJ، Krawczewski K (أبريل 2007). "Parkinsonism: a review-of-systems approach to diagnosis". Seminars in Neurology. ج. 27 ع. 2: 113–22. DOI:10.1055/s-2007-971174. PMID:17390256.
- ^ ا ب Olsen CM (ديسمبر 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. ج. 61 ع. 7: 1109–22. DOI:10.1016/j.neuropharm.2011.03.010. PMC:3139704. PMID:21459101.
- ^ Ceravolo R، Frosini D، Rossi C، Bonuccelli U (نوفمبر 2010). "Spectrum of addictions in Parkinson's disease: from dopamine dysregulation syndrome to impulse control disorders". Journal of Neurology. ج. 257 ع. Suppl 2: S276–83. DOI:10.1007/s00415-010-5715-0. PMID:21080189.
- ^ ا ب ج د ه و ز Ghodse H (2010). Ghodse's Drugs and Addictive Behaviour: A Guide to Treatment (ط. 4th). Cambridge University Press. ص. 87–92. ISBN:978-1-139-48567-8.
- ^ Heal DJ، Pierce DM (2006). "Methylphenidate and its isomers: their role in the treatment of attention-deficit hyperactivity disorder using a transdermal delivery system". CNS Drugs. ج. 20 ع. 9: 713–38. DOI:10.2165/00023210-200620090-00002. PMID:16953648.
- ^ Freye E (2009). Pharmacology and abuse of cocaine, amphetamines, ecstasy and related designer drugs a comprehensive review on their mode of action, treatment of abuse and intoxication. Dordrecht: Springer. ISBN:978-90-481-2448-0.
- ^ ا ب ج Kimko HC، Cross JT، Abernethy DR (ديسمبر 1999). "Pharmacokinetics and clinical effectiveness of methylphenidate". Clinical Pharmacokinetics. ج. 37 ع. 6: 457–70. DOI:10.2165/00003088-199937060-00002. PMID:10628897.
- ^ Mignot EJ (أكتوبر 2012). "A practical guide to the therapy of narcolepsy and hypersomnia syndromes". Neurotherapeutics. ج. 9 ع. 4: 739–52. DOI:10.1007/s13311-012-0150-9. PMC:3480574. PMID:23065655.
- ^ Zimmerman JL (أكتوبر 2012). "Cocaine intoxication". Critical Care Clinics. ج. 28 ع. 4: 517–26. DOI:10.1016/j.ccc.2012.07.003. PMID:22998988.
- ^ "Methylphenidate Hydrochloride Monograph for Professionals". Drugs.com (بالإنجليزية). AHFS. Archived from the original on 2018-12-19. Retrieved 2018-12-19.
- ^ Nutt DJ، Lingford-Hughes A، Erritzoe D، Stokes PR (مايو 2015). "The dopamine theory of addiction: 40 years of highs and lows" (PDF). Nature Reviews. Neuroscience. ج. 16 ع. 5: 305–12. DOI:10.1038/nrn3939. PMID:25873042. مؤرشف من الأصل (PDF) في 2019-09-23.
- ^ ا ب ج Sinha R (أغسطس 2013). "The clinical neurobiology of drug craving". Current Opinion in Neurobiology. ج. 23 ع. 4: 649–54. DOI:10.1016/j.conb.2013.05.001. PMC:3735834. PMID:23764204.
- ^ Volkow ND، Baler RD (يناير 2014). "Addiction science: Uncovering neurobiological complexity". Neuropharmacology. 76 Pt B: 235–49. DOI:10.1016/j.neuropharm.2013.05.007. PMC:3818510. PMID:23688927.
- ^ Nestler EJ (ديسمبر 2012). "Transcriptional mechanisms of drug addiction". Clinical Psychopharmacology and Neuroscience. ج. 10 ع. 3: 136–43. DOI:10.9758/cpn.2012.10.3.136. PMC:3569166. PMID:23430970.
- ^ Yeo BT، Krienen FM، Sepulcre J، Sabuncu MR، Lashkari D، Hollinshead M، Roffman JL، Smoller JW، Zöllei L، Polimeni JR، Fischl B، Liu H، Buckner RL (سبتمبر 2011). "The organization of the human cerebral cortex estimated by intrinsic functional connectivity". Journal of Neurophysiology. ج. 106 ع. 3: 1125–65. DOI:10.1152/jn.00338.2011. PMC:3174820. PMID:21653723.
- ^ Brunton، L (2006). Goodman and Gilman's The Pharmacological Basis of Therapeutics (ط. 12th). McGraw Hill. ص. 417–55. مؤرشف من الأصل في 2022-03-17.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ ا ب ج د Howes OD، Kapur S (مايو 2009). "The dopamine hypothesis of schizophrenia: version III—the final common pathway". Schizophrenia Bulletin. ج. 35 ع. 3: 549–62. DOI:10.1093/schbul/sbp006. PMC:2669582. PMID:19325164.
- ^ Horacek J، Bubenikova-Valesova V، Kopecek M، Palenicek T، Dockery C، Mohr P، Höschl C (2006). "Mechanism of action of atypical antipsychotic drugs and the neurobiology of schizophrenia". CNS Drugs. ج. 20 ع. 5: 389–409. DOI:10.2165/00023210-200620050-00004. PMID:16696579.
- ^ Healy D (2004). The Creation of Psychopharmacology. Harvard University Press. ص. 37–73. ISBN:978-0-674-01599-9.
- ^ James، Adam (2 مارس 2008). "Myth of the antipsychotic". The Guardian. Guardian News and Media Limited. مؤرشف من الأصل في 2019-08-09. اطلع عليه بتاريخ 2015-09-24.
- ^ Lambert M، Schimmelmann BG، Karow A، Naber D (نوفمبر 2003). "Subjective well-being and initial dysphoric reaction under antipsychotic drugs – concepts, measurement and clinical relevance". Pharmacopsychiatry. 36 Suppl 3 ع. Suppl 3: S181–90. DOI:10.1055/s-2003-45128. PMID:14677077.
- ^ Muench J، Hamer AM (مارس 2010). "Adverse effects of antipsychotic medications". American Family Physician. ج. 81 ع. 5: 617–22. PMID:20187598.
- ^ ا ب Malenka RC، Nestler EJ، Hyman SE (2009). "Chapters 10 and 13". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (ط. 2nd). New York: McGraw-Hill Medical. ص. 266, 318–23. ISBN:978-0-07-148127-4.
- ^ Wu J، Xiao H، Sun H، Zou L، Zhu LQ (يونيو 2012). "Role of dopamine receptors in ADHD: a systematic meta-analysis". Molecular Neurobiology. ج. 45 ع. 3: 605–20. DOI:10.1007/s12035-012-8278-5. PMID:22610946.
- ^ ا ب Berridge CW، Devilbiss DM (يونيو 2011). "Psychostimulants as cognitive enhancers: the prefrontal cortex, catecholamines, and attention-deficit/hyperactivity disorder". Biological Psychiatry. ج. 69 ع. 12: e101–11. DOI:10.1016/j.biopsych.2010.06.023. PMC:3012746. PMID:20875636.
- ^ Spencer RC، Devilbiss DM، Berridge CW (يونيو 2015). "The cognition-enhancing effects of psychostimulants involve direct action in the prefrontal cortex". Biological Psychiatry. ج. 77 ع. 11: 940–50. DOI:10.1016/j.biopsych.2014.09.013. PMC:4377121. PMID:25499957.
- ^ Ilieva IP، Hook CJ، Farah MJ (يونيو 2015). "Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis". Journal of Cognitive Neuroscience. ج. 27 ع. 6: 1069–89. DOI:10.1162/jocn_a_00776. PMID:25591060. مؤرشف من الأصل في 2019-09-26.
- ^ Wood PB (مايو 2008). "Role of central dopamine in pain and analgesia". Expert Review of Neurotherapeutics. ج. 8 ع. 5: 781–97. DOI:10.1586/14737175.8.5.781. PMID:18457535.
- ^ Flake ZA، Scalley RD، Bailey AG (مارس 2004). "Practical selection of antiemetics". American Family Physician. ج. 69 ع. 5: 1169–74. PMID:15023018. مؤرشف من الأصل في 2019-04-20.
- ^ Connolly BS، Lang AE (2014). "Pharmacological treatment of Parkinson disease: a review". JAMA. ج. 311 ع. 16: 1670–83. DOI:10.1001/jama.2014.3654. PMID:24756517.
- ^ Roshchina VV (2010). "Evolutionary considerations of neurotransmitters in microbial, plant, and animal cells". Microbial Endocrinology. New York: Springer. ص. 17–52. ISBN:978-1-4419-5576-0.
- ^ ا ب Iyer LM، Aravind L، Coon SL، Klein DC، Koonin EV (يوليو 2004). "Evolution of cell-cell signaling in animals: did late horizontal gene transfer from bacteria have a role?". Trends in Genetics. ج. 20 ع. 7: 292–99. DOI:10.1016/j.tig.2004.05.007. PMID:15219393.
- ^ ا ب ج د ه Barron AB، Søvik E، Cornish JL (2010). "The roles of dopamine and related compounds in reward-seeking behavior across animal phyla". Frontiers in Behavioral Neuroscience. ج. 4: 163. DOI:10.3389/fnbeh.2010.00163. PMC:2967375. PMID:21048897.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Liu H، Mishima Y، Fujiwara T، Nagai H، Kitazawa A، Mine Y، وآخرون (2004). "Isolation of Araguspongine M, a new stereoisomer of an Araguspongine/Xestospongin alkaloid, and dopamine from the marine sponge Neopetrosia exigua collected in Palau". Marine Drugs. ج. 2 ع. 4: 154–63. DOI:10.3390/md204154. PMC:3783253.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Kass-Simon G، Pierobon P (يناير 2007). "Cnidarian chemical neurotransmission, an updated overview". Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology. ج. 146 ع. 1: 9–25. DOI:10.1016/j.cbpa.2006.09.008. PMID:17101286.
- ^ Cottrell GA (يناير 1967). "Occurrence of dopamine and noradrenaline in the nervous tissue of some invertebrate species". British Journal of Pharmacology and Chemotherapy. ج. 29 ع. 1: 63–69. DOI:10.1111/j.1476-5381.1967.tb01939.x. PMC:1557178. PMID:19108240.
- ^ Kindt KS، Quast KB، Giles AC، De S، Hendrey D، Nicastro I، Rankin CH، Schafer WR (أغسطس 2007). "Dopamine mediates context-dependent modulation of sensory plasticity in C. elegans". Neuron. ج. 55 ع. 4: 662–76. DOI:10.1016/j.neuron.2007.07.023. PMID:17698017.
- ^ ا ب Waddell S (يونيو 2013). "Reinforcement signalling in Drosophila; dopamine does it all after all". Current Opinion in Neurobiology. ج. 23 ع. 3: 324–29. DOI:10.1016/j.conb.2013.01.005. PMC:3887340. PMID:23391527.
- ^ Kulma A، Szopa J (2007). "Catecholamines are active compounds in plants". Plant Science. ج. 172 ع. 3: 433–40. DOI:10.1016/j.plantsci.2006.10.013.
- ^ Simon JD، Peles D، Wakamatsu K، Ito S (أكتوبر 2009). "Current challenges in understanding melanogenesis: bridging chemistry, biological control, morphology, and function". Pigment Cell & Melanoma Research. ج. 22 ع. 5: 563–79. DOI:10.1111/j.1755-148X.2009.00610.x. PMID:19627559.
- ^ Andrews RS، Pridham JB (1967). "Melanins from DOPA-containing plants". Phytochemistry. ج. 6 ع. 1: 13–18. DOI:10.1016/0031-9422(67)85002-7.
- ^ Beldade P، Brakefield PM (يونيو 2002). "The genetics and evo-devo of butterfly wing patterns". Nature Reviews. Genetics. ج. 3 ع. 6: 442–52. DOI:10.1038/nrg818. PMID:12042771.
- ^ Fedorow H، Tribl F، Halliday G، Gerlach M، Riederer P، Double KL (فبراير 2005). "Neuromelanin in human dopamine neurons: comparison with peripheral melanins and relevance to Parkinson's disease". Progress in Neurobiology. ج. 75 ع. 2: 109–24. DOI:10.1016/j.pneurobio.2005.02.001. PMID:15784302.
- ^ Ingle PK (2003). "L-DOPA bearing plants" (PDF). Natural Product Radiance. ج. 2: 126–133. مؤرشف (PDF) من الأصل في 2018-09-16. اطلع عليه بتاريخ 2015-09-24.
- ^ Wichers HJ، Visser JF، Huizing HJ، Pras N (1993). "Occurrence of L-DOPA and dopamine in plants and cell cultures of Mucuna pruriens and effects of 2, 4-d and NaCl on these compounds". Plant Cell, Tissue and Organ Culture. ج. 33 ع. 3: 259–64. DOI:10.1007/BF02319010.
- ^ Longo R، Castellani A، Sberze P، Tibolla M (1974). "Distribution of l-dopa and related amino acids in Vicia". Phytochemistry. ج. 13 ع. 1: 167–71. DOI:10.1016/S0031-9422(00)91287-1.
- ^ Fahn S (2008). "The history of dopamine and levodopa in the treatment of Parkinson's disease". Movement Disorders. 23 Suppl 3: S497–508. DOI:10.1002/mds.22028. PMID:18781671.
- ^ Benes FM (يناير 2001). "Carlsson and the discovery of dopamine". Trends in Pharmacological Sciences. ج. 22 ع. 1: 46–47. DOI:10.1016/S0165-6147(00)01607-2. PMID:11165672.
- ^ Barondes، Samuel H. (2003). Better Than Prozac. New York: Oxford University Press. ص. 21–22, 39–40. ISBN:978-0-19-515130-5. مؤرشف من الأصل في 2020-01-09.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Lee H، Dellatore SM، Miller WM، Messersmith PB (أكتوبر 2007). "Mussel-inspired surface chemistry for multifunctional coatings". Science. ج. 318 ع. 5849: 426–30. Bibcode:2007Sci...318..426L. DOI:10.1126/science.1147241. PMC:2601629. PMID:17947576.
- ^ Dreyer DR، Miller DJ، Freeman BD، Paul DR، Bielawski CW (2013). "Perspectives on poly(dopamine)". Chemical Sciences. ج. 4 ع. 10: 3796. DOI:10.1039/C3SC51501J.
- ^ Lynge ME، van der Westen R، Postma A، Städler B (ديسمبر 2011). "Polydopamine—a nature-inspired polymer coating for biomedical science" (PDF). Nanoscale. ج. 3 ع. 12: 4916–28. Bibcode:2011Nanos...3.4916L. DOI:10.1039/c1nr10969c. PMID:22024699. مؤرشف من الأصل في 2014-03-07.