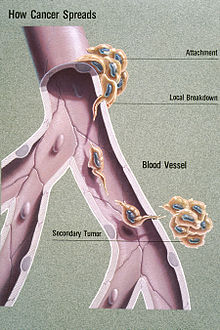
انبثاث
نقيلة[1][2] أو الانبثاث[2][3] أو هجرة الخلايا السرطانية (بالإنجليزية: Metastasis) يُقصد بها عملية انتقال الخلايا السرطانية من عضو إلى آخر. تحدث هذه العملية عند انتقال الخلايا عن طريق الدم أو الجهاز الليمفي، ويُشار للسرطان في العضو الجديد بالسرطان الثانوي. تتم السيطرة على النقائل بواسطة أحد طرق علاج السرطان التقليدية كالعلاج الكيميائي والإشعاعي والجراحة.[4][5]
| نقيلة انبثاث | |
|---|---|
رسم توضيحي يظهر انبثاث دموي المنشأ
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | الأورام الثانوية ، وورم |
| التاريخ | |
| وصفها المصدر | الموسوعة السوفيتية الكبرى ، والموسوعة السوفيتية الأرمينية، المجلد السابع |
| تعديل مصدري - تعديل | |
يحدث السرطان بعد تلف خلية واحدة في الأنسجة وراثيًا لإنتاج الخلايا السرطانية مع الانقسام العشوائي. هذا الانقسام الميتوزي غير المنضبط يُنتج الورم الأوّلي. تخضع الخلايا التي تشكل الورم في النهاية إلى الحؤول، يليه النمو الشاذ ثم الكشم (فقْد التمايز الخلوي)، مما يؤدي إلى النمط الظاهري الخبيث. ينتشر هذا الورم الخبيث في الدورة الدموية، ثم ينتشر لمواقع ثانية لتكوين الأورام.
تكتسب بعض الخلايا السرطانية القدرة على اختراق جدران الأوعية اللمفاوية و / أو الأوعية الدموية، وبعد ذلك تصبح قادرة على الدوران خلال مجرى الدم (الخلايا السرطانية المنتشرة) إلى المواقع والأنسجة الأخرى في الجسم. تُعرف هذه العملية بالانتشار اللمفاوي أو الانتشار الدموي. بعد وصول الخلايا السرطانية لموقع آخر، تُعيد اختراق الأوعية والأنسجة وتستمر بالتكاثر، تشكل في النهاية الورم والذي يمكن كشفه سريريًا. يُعرف هذا الورم الجديد بأنه الورم المتنقل (أو الثانوي). الانبثاث هو أحد «علامات السرطان»، التي تميزه عن الأورام الحميدة.[6] يمكن أن تنتقل معظم الأورام، ولكن بدرجات متفاوتة (على سبيل المثال، نادرًا ما ينتقل سرطان الخلايا القاعدية).
عندما تنتقل الخلايا السرطانية، يُسمى الورم الجديد ورم ثانوي أو نقيلي، وتكون خلاياه مماثلة لتلك الموجودة في الورم الأصلي أو الأساسي. وهذا يعني، على سبيل المثال، أنه إذا انتشر سرطان الثدي إلى الرئتين، وتكوّن الورم الثانوي من خلايا الثدي غير الطبيعية، وليس من خلايا الرئة غير الطبيعية. من ثَمّ يُدعى الورم في الرئة سرطان الثدي النقيلي، وليس سرطان الرئة. الانبثاث هو عنصر أساسي في أنظمة تقسيم مراحل السرطان مثل نظام تصنيف الورم والعقد والنقائل TNM، حيث يمثل "M". ويضع السرطان بشكل عام في التقسيم في المرحلة الرابعة. تنخفض إمكانية العلاج إلى حد كبير، أو في كثير من الأحيان، لاتكون هناك إمكانية للعلاج في حالات السرطانات المنتشرة.
العلامات والأعراض
عدلتختلف أعراض وعلامات النقائل باختلاف موقع الورم. في البداية، تُصاب الغدد الليمفاوية المجاورة في وقت مبكر. وأكثر المواقع عرضًة للانتشار من الأورام الخبيثة الصلبة[7] هي الرئتين، الكبد، الدماغ والعظام.
- في الغدد الليمفاوية، العَرَض الشائع هو اعتلال العقد اللمفية
- الرئتين: السعال، ونفث الدم وضيق التنفس[7]
- الكبد: تضخم الكبد، الغثيان، واليرقان
- العظام: آلام العظام[7]، وكسور في العظام المتضررة
- الدماغ: الأعراض العصبية مثل الصداع، التشنجات، والدوار
على الرغم من أن السرطان في مراحله المتقدمة قد يسبب الألم[7]، إلا أنه غالبًا ما لا يكون العرض الأول. وقد لا تظهر أي أعراض عند بعض المرضى. عندما يُصاب عضو ما بسرطان منتشر فإنه يبدأ في الانكماش حتى تنفجر الغدد الليمفاوية له، أوتتحلل.
الفيسيولوجيا المرضية
عدلالعوامل المؤثرة
عدلالانبثاث هو سلسلة معقدة من الخطوات التي تغادر فيها الخلايا السرطانية موقع الورم الأصلي وتهاجر إلى أجزاء أخرى من الجسم عبر مجرى الدم، والجهاز اللمفاوي، أو الانتشار المباشر. للقيام بذلك، تبتعد الخلايا الخبيثة عن الورم الرئيسي وترتبط ببروتينات وتكسرها مما يشكل المنطقة المحيطة خارج الخلية (ECM)، والتي تفصل بين الورم والأنسجة المجاورة. بواسطة تكسير هذه البروتينات، تصبح الخلايا السرطانية قادرة على اختراق المنطقة المحيطة بالخلية والهروب. لايكون موقع الانبثاث عشوائيًا دائمًا، فهناك أنواع مختلفة من السرطان تميل إلى الانتشار إلى أعضاء وأنسجة معينة بمعدل أعلى مما كان متوقعًا بالافتراضات الإحصائية وحدها.[8] على سبيل المثال؛ يميل سرطان الثدي إلى الانبثاث إلى العظام والرئتين. ويبدو أن هذه الخصوصية تتم بواسطة جزيئات إشارة قابلة للذوبان مثل الكيموكينات (منشطات كيميائية)[9]، وتحوُّل عامل النمو بيتا. يقاوم الجسم الورم الخبيث عن طريق مجموعة متنوعة من الآليات من خلال فئة من البروتينات المعروفة باسم مثبطات الانبثاث[10]، والتي يُعرف منها عشرات.[11]
تقوم الخلايا البشرية بثلاثة أنواع من الحركة: الحركة الجماعية، حركة متوسطية، وحركة أميبية. تبدل الخلايا السرطانية في كثير من الأحيان بين أنواع مختلفة من الحركة. ويأمل بعض الباحثين في مجال السرطان لإيجاد العلاجات التي يمكن أن توقف أو على الأقل تبطيء انتشار السرطان عن طريق عرقلة أحد أو كلا النوعين من الحركة.[12]
وقد اكتشف باحثو السرطان الدارسين للظروف اللازمة للانبثاث أن واحدًا من الأحداث الهامة المطلوبة هو نمو شبكة جديدة من الأوعية الدموية، تُدعى تولُّد أوعية الورم.[13] لذا فقد وُجد أن مثبطات تكوُّن الأوعية الدموية تمنع نمو الانبثاث.
هناك عدة أنواع مختلفة من الخلايا حاسمة لنمو الورم. على وجه الخصوص، ثبت أن الخلايا الأولية البطانية لها تأثير قوي على نمو الأوعية الدموية المصابة. ومن هذه النتيجة تثبت أهمية الخلايا البطانية الأولية [14][15] في توليد الأوعية الدموية للسرطان والانبثاث. علاوة على ذلك، يؤدي اجتثاث الخلايا البطانية الأولية من نخاع العظام إلى انخفاض كبير في نمو الورم وتكوُّن الأوعية الدموية. لذلك، فإن الخلايا البطانية الأولية مهمة جدًا في بيولوجيا الورم وهي أحد الأهداف العلاجية الجديدة حاليًا.[16]
طرق الانبثاث
عدليحدث الانتقال عن طريق اتباع أربعة مسارات:
1. عبر الجوف
عدليمكن أن يحدث انتشار الورم الخبيث في تجاويف الجسم عن طريق اختراق التجاويف مثل التجويف البريتوني، الجنبي، التاموري، أو تحت العنكبوتية. على سبيل المثال، يمكن أن تنتشر أورام المبيض عبر التجويف البريتوني لتصل إلى الكبد.
2. الانتشار اللمفاوي
عدليسمح الانتشار اللمفاوي بنقل الخلايا السرطانية إلى الغدد الليمفاوية، وبالتالي، إلى أجزاء أخرى من الجسم. وهذا هو الطريق الأكثر شيوعًا لانبثاث الأورام الخبيثة. في المقابل، من غير المألوف للساركوما أن تنتشر عبر هذا الطريق. ومن الجدير بالذكر أن الجهاز الليمفاوي يصب في نهاية المطاف في الجهاز الوريدي عن طريق الوريد المفرد، وبالتالي يمكن لهذه الخلايا المنبثة أن تنتشر عن طريق الدم.
3. الانتشار الدموي
عدلهذا هو الطريق النموذجي لانبثاث الساركوما، وهو أيضًا الطريق المفضل لأنواع معينة من السرطان، مثل تلك التي تنشأ في الكلى (سرطان الخلايا الكلوية). تُصاب الأوردة أكثر في كثير من الأحيان من الشرايين بسبب رقة جدرانها، كما يميل الانبثاث إلى اتباع نمط التدفق الوريدي.
4. الزرع أو الانغراس
عدلقد تنتشر الخلايا السرطانية إلى الغدد الليمفاوية (العقد الليمفاوية للمنطقة المصابة) بالقرب من الورم الرئيسي. وهذا ما يسمى التورط العقدي. «العقد الإيجابية» هو المصطلح الذي يمكن أن يستعمله الأطباء المتخصصين لوصف حالة المريض، وهذا يعني أن العقد اللمفاوية للمريض بالقرب من الورم الرئيسي أصبحت إيجابية للورم الخبيث. من الممارسات الطبية الشائعة للاختبار أخذ خزعة من اثنين على الأقل من العقد الليمفاوية بالقرب من موقع الورم أثناء العملية الجراحية من أجل الفحص أو إزالة الورم. .
لا يعد انتشار السرطان إلى الغدد الليمفاوية القريبة من الورم الرئيسي انبثاث، على الرغم من أنه علامة سيئة في تقدم المرض. النقل عن طريق الأوعية اللمفاوية هو الطريق الأكثر شيوعًا للانتشار الأوّلي للسرطانات.
استهداف الأعضاء
عدلهناك ميل لبعض الأورام للانتشار في أعضاء معينة. وقد ناقش ستيفن باجيت هذا الأمر لأول مرة تحت مُسمّى نظرية «البذور والتربة» منذ أكثر من قرن، في عام 1889. على سبيل المثال، عادةً ينتشر سرطان البروستاتا للعظام. بطريقة مماثلة، يميل سرطان القولون للانتشار إلى الكبد. وفي كثير من الأحيان ينتشر سرطان المعدة إلى المبيض في النساء، ومن ثَمّ يُدعى ورم كروكينبيرغ.
ِوفقًا لنظرية «البذور والتربة»، فمن الصعب على الخلايا السرطانية البقاء خارج منطقة الورم الأصلية، لذلك من أجل الانتشار يجب أن تجد مكانًا لها ذو خصائص مماثلة.[18] على سبيل المثال، تنتشر الخلايا السرطانية بالثدي، والتي تجمع أيونات الكالسيوم من حليب الثدي، إلى أنسجة العظام، حيث يمكن جمع أيونات الكالسيوم من العظام. وكذلك ينتشر سرطان الجلد الخبيث إلى الدماغ، ربما لأن الأنسجة العصبية والخلايا الصباغية تنشآن من نفس خط الخلية في الجنين.[19]
في عام 1928، تحدى جيمس يوينغ نظرية «البذور والتربة»، واقترح أن انتشار الورم الخبيث يحدث بمحض الطرق التشريحية والميكانيكية. وقد استخدُمت هذه الفرضية مؤخرًا للإشارة إلى عدة فرضيات حول دورة حياة الخلايا السرطانية (CTCs) والافتراض بأن أنماط الانتشار يمكن أن تُفهم على نحو أفضل من خلال نظرية «التصفية والتدفُّق».[20]
الانبثاث والسرطان الأوّلي
عدلهناك نظرية بأن الانبثاث يتزامن دائمًا مع السرطان الأوّلي، ولكن أكثر من 10٪ من المرضى في وحدات الأورام سيكون لديهم انبثاث دون الكشف عن الورم الرئيسي. في هذه الحالات، يشير الأطباء إلى الورم الرئيسي باسم «المجهول» أو «الغامض»، ويكون المريض مُصابًا بسرطان مجهول المنشأ (CUP) أو الأورام الأوّلية غير المعروفة (UPT).[21] تشير التقديرات إلى أن 3٪ من جميع حالات السرطان ذات منشأ غير معروف.[22] وقد أظهرت الدراسات أنه إذا لم يكشف الاستجواب البسيط عن مصدر السرطان (سعال دموي «ربما الرئة»، والتبول الدموي «ربما المثانة»)، فإن التصوير المعقد قد لا يكشفه أيضًا.[22] في بعض هذه الحالات قد يظهر الورم الرئيسي في وقت لاحق. سمح استخدام الكيمياء النسيجية المناعية للأطباء بإعطاء هوية لكثير من هذه النقائل. ومع ذلك، نادرًا ما يوضح تصوير المنطقة المشار إليها الورم الرئيسي. في حالات نادرة (على سبيل المثال، سرطان الجلد)، لم يتم العثور على الورم الرئيسي، حتى عند تشريح الجثة. وبالتالي فإنه يُعتقد أن بعض الأورام الأوّلية يمكن أن تتراجع كليًا، ولكن يستمر الانبثاث.
المواقع الأوّلية الأكثر شيوعًا
عدلالتشخيص
عدلتشبه الخلايا في الورم النقيلي تلك الموجودة في الورم الرئيسي. فبمجرد فحص الأنسجة السرطانية تحت المجهر لتحديد نوع الخلية، يمكن للطبيب عادة أن يقول ما إذا كان هذا النوع من الخلايا يوجد طبيعيًا في جزء الجسم الذي تم أخذ عينة الأنسجة منه.
على سبيل المثال، تملك خلايا سرطان الثدي الشكل نفسه سواء وُجدت في الثدي أو انتشرت إلى أجزاء أخرى من الجسم. لذا، إذا أُخذت عينة من ورم في الرئة يحتوي على خلايا تشبه خلايا الثدي، يحدد الطبيب أن الورم في الرئة هو ورم ثانوي. ومع ذلك، فإن تحديد الورم الرئيسي يمكن أن يكون صعبًا جدًا في كثير من الأحيان، ويمكن أن يحتاج اختصاصي الباثولوجيا لاستخدام العديد من التقنيات المساعدة، مثل الكيمياء النسيجية المناعية، اختبار FISH، وغيرها. وعلى الرغم من استخدام هذه التقنيات، يظل الورم الرئيسي مجهولًا في بعض الحالات.
يمكن الكشف عن السرطان النقيلي في نفس وقت الورم الرئيسي، أو خلال أشهر أو سنوات تالية. وعندما يُعثَر على ورم ثانوي في مريض عُولِج من السرطان من قبل، فإنه كثيرًا ما يكون انبثاثًا أكثر منه ورم أوّلي آخر.
كان يُعتقد في السابق أن معظم الخلايا السرطانية لديها إمكانات انتقال منخفضة وأن هناك خلايا نادرة تنمّي القدرة على الانتقال من خلال حدوث طفرات جسدية.[25] ووِفقًا لهذه النظرية، يكون تشخيص السرطانات النقيلية ممكنًا فقط بعد حدوث الانبثاث.[26]
لم تثبُت نظرية الطفرة الجسدية لحدوث الانبثاث في السرطانات البشرية. بدلًا من ذلك، يبدو أن الحالة الوراثية للورم الرئيسي تعكس قدرة السرطان على الانتشار. حدّد البحث بمقارنة التعبير الجيني بين السرطانات الغدّية الأولية والمنتشرة، مجموعة فرعية من الجينات والتي يمكن أن تميز الأورام الأولية من الأورام النقيلية، يُطلق عليها اسم «الدليل النقيلي.» لُوحظ أيضًا تعبير هذه الجينات المرتبط بالانبثاث في بعض الأورام الأولية، مشيرًا إلى إمكانية تحديد الخلايا التي لديها قدرة على الانبثاث في وقت واحد مع تشخيص الورم الرئيسي.[27]
ارتبط هذا الدليل النقيلي بسوء التشخيص، وكان للانبثاث من سرطان الثدي، الورم الأرومي النخاعي وسرطان البروستاتا أنماط تعبير مماثلة من هذه الجينات المرتبطة بالانبثاث.
أعطى تحديد هذا الدليل النقيلي الأمل في تحسين تشخيص السرطانات المرتبطة بالانبثاث، وأيضًا تثبيط انتقال السرطانات.
-
قطاع من عظمة العضد يظهر طوليًا، موضحًا انبثاث سرطاني كبير (الورم الأبيض بين رأس وجسم العظمة)
-
صورة أشعة مقطعية لانبثاثات متعددة بالكبد
-
صورة أشعة مقطعية لانبثاث في الرئة
-
انبثاث ثبُت عن طريق خزعة من الكبد (الورم (سرطانة غدية)- ثلثي الصورة بالأسفل). صبغة الهيماتوكسيلين والإيوسين
-
سرطان منتشر في الرئتين
العلاج
عدليُحدَد العلاج ومدى البقاء على قيد الحياة إلى حد كبير من خلال ما إذا كان السرطان لا يزال في موقعه الأصلي أو انتشر إلى أماكن أخرى في الجسم. فإذا انتقل السرطان إلى أنسجة أو أعضاء أخرى، عادةً ما يزيد بشكل كبير احتمال موت المريض. يمكن لبعض أنواع السرطان مثل سرطان الدم، أو الأورام الخبيثة في المخ أن تؤدي إلى الوفاة دون أن تننشر.
بمجرد انتشار السرطان فإنه قد لا يزال علاجه ممكنًا بالجراحة الإشعاعية، العلاج الكيميائي، العلاج الإشعاعي، العلاج البيولوجي، العلاج الهرموني، والجراحة، أو مزيج من هذه التدخلات («العلاج متعدد الوسائط»). يتعمد اختيار العلاج على عدد كبير من العوامل، بما في ذلك نوع السرطان الأولي، حجم وموقع الانبثاث، عُمْر المريض وصحته العامة، وأنواع العلاجات المُستخدمة سابقًا. غالبًا ما يكون علاج المرضى الذين شُخِّصت إصابتهم بسرطانات مجهولة المنشأ ممكنًا حتى دون تحديد موقع الورم الرئيسي.
نادرًا ما تتمكن العلاجات الحالية من علاج السرطان المنتشر لمواقع عديدة، على الرغم من إمكانية علاج بعض الأورام مثل سرطان الخصية وسرطان الغدة الدرقية.
الأبحاث
عدلعلى الرغم من القبول على نطاق واسع بفكرة أن يكون الانبثاث نتيجة لهجرة الخلايا السرطانية، إلا أن هناك فرضية تقول أن بعض أنواع الانبثاث هي نتيجة العمليات الالتهابية من الخلايا المناعية غير الطبيعية.[28] وأيضًا يشير وجود السرطان المنتشر في حالة عدم وجود الأورام الأولية أن الانبثاث لا يحدث دائمًا من هجرة الخلايا الخبيثة من الأورام الأولية.[29]
التاريخ
عدلفي مارس 2014، اكتشف الباحثون أقدم مثال كامل للإنسان المُصاب بالسرطان النقيلي. وُجدت الأورام في هيكل عظمي يبلغ من العمر 3000 سنة، عُثِر عليه في عام 2013 في مقبرة في السودان يعود تاريخها إلى 1200 قبل الميلاد. تم تحليل الهيكل العظمي باستخدام التصوير الشعاعي والمجهر الإلكتروني. ونُشرت هذه النتائج في صحيفة المكتبة العامة للعلوم.[30][31][32]
التسمية
عدلالانبثاث هي كلمة يونانية تعني «النزوح»، مُكوَّنة من μετά، «مُجاوِر»، وστάσις، «وَضْع».
انظر أيضًا
عدلالمراجع
عدل- ^ محمد هيثم الخياط (2009). المعجم الطبي الموحد: إنكليزي - فرنسي - عربي (بالعربية والإنجليزية والفرنسية) (ط. الرابعة). بيروت: مكتبة لبنان ناشرون، منظمة الصحة العالمية. ص. 1253. ISBN:978-9953-86-482-2. OCLC:978161740. QID:Q113466993.
- ^ ا ب يوسف حتي؛ أحمد شفيق الخطيب (2011). قاموس حتي الطبي الجديد: طبعة جديدة وموسعة ومعززة بالرسوم إنكليزي - عربي مع ملحقات ومسرد عربي - إنكليزي (بالعربية والإنجليزية) (ط. الأولى). بيروت: مكتبة لبنان ناشرون. ص. 531. ISBN:978-9953-86-883-7. OCLC:868913367. QID:Q112962638.
- ^ قاموس المورد، البعلبكي، بيروت، لبنان.
- ^ Klein CA (سبتمبر 2008). "Cancer. The metastasis cascade". Science. ج. 321 ع. 5897: 1785–7. DOI:10.1126/science.1164853. PMID:18818347.
- ^ Chiang AC، Massagué J (ديسمبر 2008). "Molecular basis of metastasis". The New England Journal of Medicine. ج. 359 ع. 26: 2814–23. DOI:10.1056/NEJMra0805239. PMC:4189180. PMID:19109576.
- ^ Kumar، Vinay؛ Abbas، Abul K؛ Fausto، Nelson؛ Robbins، Stanley L؛ Cotran، Ramzi S (2005). Robbins and Cotran pathologic basis of disease (ط. 7th). Philadelphia: Elsevier Saunders. ISBN:978-0-7216-0187-8.
- ^ ا ب ج د National Cancer Institute: Metastatic Cancer: Questions and Answers. Retrieved on 2008-11-01 نسخة محفوظة 26 فبراير 2015 على موقع واي باك مشين.
- ^ Don X. Nguyen and Joan Massagué, Genetic determinants of cancer metastasis, Nature, 2007. http://www.nature.com/nrg/journal/v8/n5/pdf/nrg2101.pdf نسخة محفوظة 1 سبتمبر 2015 على موقع واي باك مشين.
- ^ Zlotnik A., Burkhardt A. M., Homey B., Homeostatic chemokine receptors and organ-specific metastasis, Nature reviews, 2007
- ^ Yvette Drabsch, Peter ten Dijke, TGF-β Signaling in Breast Cancer Cell Invasion and Bone Metastasis, J Mammary Gland Biol Neoplasia (2011) 16:97–108
- ^ Yoshida BA، Sokoloff MM، Welch DR، Rinker-Schaeffer CW (نوفمبر 2000). "Metastasis-suppressor genes: a review and perspective on an emerging field". J Natl Cancer Inst. ج. 92 ع. 21: 1717–30. DOI:10.1093/jnci/92.21.1717. PMID:11058615. مؤرشف من الأصل في 2009-06-18.
- ^ Matteo Parri, Paola Chiarugi. "Rac and Rho GTPases in cancer cell motility control" 2010 نسخة محفوظة 24 يوليو 2015 على موقع واي باك مشين.
- ^ Weidner N، Semple JP، Welch WR، Folkman J (يناير 1991). "Tumor angiogenesis and metastasis—correlation in invasive breast carcinoma". N Engl J Med. ج. 324 ع. 1: 1–8. DOI:10.1056/NEJM199101033240101. PMID:1701519. مؤرشف من الأصل في 2009-02-16.
- ^ Gao، D؛ Nolan، D. J.؛ Mellick، A. S.؛ Bambino، K.؛ McDonnell، K.؛ Mittal، V. (2008). "Endothelial Progenitor Cells Control the Angiogenic Switch in Mouse Lung Metastasis". Science. ج. 319 ع. 5860: 195–198. Bibcode:2008Sci...319..195G. DOI:10.1126/science.1150224. PMID:18187653.
- ^ Nolan، DJ؛ Ciarrocchi، A.؛ Mellick، A. S.؛ Jaggi، J. S.؛ Bambino، K.؛ Gupta، S.؛ Heikamp، E.؛ McDevitt، M. R.؛ Scheinberg، D. A.؛ B.، R.؛ Mittal1، V. (2007). "Bone marrow-derived endothelial progenitor cells are a major determinant of nascent tumor neovascularization". Genes & Development. ج. 21 ع. 12: 1546–1558. DOI:10.1101/gad.436307. PMC:1891431. PMID:17575055.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) - ^ Mellick As؛ Plummer PN؛ وآخرون (2010). "Using the Transcription Factor Inhibitor of DNA Binding 1 to Selectively Target Endothelial Progenitor Cells Offers Novel Strategies to Inhibit Tumor Angiogenesis and Growth". Cancer Research. ج. 70 ع. 18: 7273–7282. DOI:10.1158/0008-5472.CAN-10-1142. PMC:3058751. PMID:20807818.
- ^ List of included entries and references is found on main image page in Commons: Commons:File:Metastasis sites for common cancers.svg#Summary
- ^ Hart، Ian R. "'Seed and soil' revisited: mechanisms of site-specific metastasis". Cancer Metast Rev. ج. 1 ع. 1: 5–16. DOI:10.1007/BF00049477. مؤرشف من الأصل في 2018-06-13 – عبر link.springer.com.
- ^ Robert Weinberg, The Biology of Cancer, cited in Basics: A mutinous group of cells on a greedy, destructive task, by Natalie Angier, New York Times, 3 April 2007 نسخة محفوظة 16 يناير 2018 على موقع واي باك مشين.
- ^ Scott، J؛ Kuhn, P؛ Anderson, A (يوليو 2012). "Unifying metastasis — integrating intravasation, circulation and end-organ colonization". Nature Reviews Cancer. ج. 12 ع. 7: 445–446. DOI:10.1038/nrc3287. PMID:22912952.
- ^ Ettinger؛ وآخرون (2011). "Occult primary". J Natl Compr Canc Netw. ج. 9 ع. 12: 1358–95. PMID:22157556.
- ^ ا ب Briasoulis E، Pavlidis N (1997). "Cancer of Unknown Primary Origin". Oncologist. ج. 2 ع. 3: 142–152. PMID:10388044. مؤرشف من الأصل في 2009-08-22.
- ^ Mokahhal، Mohammed (2010). Metastasis. California: Robbins and Cotran. ص. 270.
- ^ "Metastatic Cancer: Questions and Answers". National Cancer Institute. مؤرشف من الأصل في 2015-02-26. اطلع عليه بتاريخ 2008-08-28.
- ^ Poste G، Fidler IJ (يناير 1980). "The pathogenesis of cancer metastasis". Nature. ج. 283 ع. 5743: 139–46. Bibcode:1980Natur.283..139P. DOI:10.1038/283139a0. PMID:6985715.
- ^ Ramaswamy S، Ross KN، Lander ES، Golub TR (يناير 2003). "A molecular signature of metastasis in primary solid tumors". Nature Genetics. ج. 33 ع. 1: 49–54. DOI:10.1038/ng1060. PMID:12469122.
- ^ van 't Veer LJ؛ Dai H؛ van de Vijver MJ؛ وآخرون (يناير 2002). "Gene expression profiling predicts clinical outcome of breast cancer". Nature. ج. 415 ع. 6871: 530–6. DOI:10.1038/415530a. PMID:11823860.
- ^ Shahriyari، Leili (2016). "A new hypothesis: some metastases are the result of inflammatory processes by adapted cells, especially adapted immune cells at sites of inflammation". F1000Research. ج. 5: 175. DOI:10.12688/f1000research.8055.1. PMC:4847566. PMID:27158448. مؤرشف من الأصل في 2018-06-01.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ López-Lázaro، Miguel (1 يناير 2015). "The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis". Oncoscience. ج. 2 ع. 5: 467–475. DOI:10.18632/oncoscience.159. ISSN:2331-4737. PMC:4468332. PMID:26097879.
- ^ Kelland، Kate (17 مارس 2014). "Archaeologists discover earliest example of human with cancer". Reuters. مؤرشف من الأصل في 2015-10-02. اطلع عليه بتاريخ 2014-03-18.
- ^ Ghosh، Pallab (18 مارس 2014). "Ancient skeleton is the earliest case of cancer yet detected". BBC. مؤرشف من الأصل في 2017-12-25. اطلع عليه بتاريخ 2014-03-18.
- ^ Ross، Philip (17 مارس 2014). "Possible Oldest Cancer Found In 3,000-Year-Old Skeleton Could Reveal 'Evolution' Of Modern Disease". International Business Times. مؤرشف من الأصل في 2018-02-11. اطلع عليه بتاريخ 2014-03-18.
وصلات خارجية
عدلمعلومات طبية حول السرطان النقيلي
- Q&A: Metastatic Cancer—from the المعهد الوطني للسرطان
- Invasion and Metastases—from Cancer Medicine e.5
- How Cancer Grows and Spreads—an interactive Flash presentation that explores the progression of a carcinoma from a single cell to metastasis; from مستشفى بوسطن للأطفال
الجمعيات الخيرية والجماعات التي تتعامل مع السرطان النقيلي
- The MetaCancer Foundation—resources and support for metastatic cancer survivors and their caregivers
- Metastatic Breast Cancer Network
- Children's Cancer Research Charity for Metastatic Cancer in Kids