نظائر الهيليوم
للهيليوم (He) تسعة نظائر معروفة، ولكن فقط النظيران هيليوم-3 3He وهيليوم-4 4He هما الوحيدان الثابتان. كل النظائر المشعة قصيرة العمر، أطولها هو 6He بعمر نصف مقداره 806.7 ميلي ثانية، أما أقصرها أمداً فهو النظير 5He بعمر نصف مقداره 7.6×10−22 ثانية.
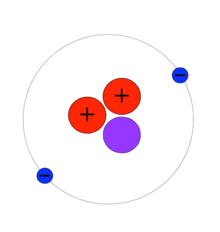
هيليوم-2
عدلالنظير 2He هيليوم-2، ويسمى أيضاً ثنائي البروتون diproton، وهو نظير غير ثابت اطلاقاً للهيليوم. يتألف هيليوم-2 أو He-2 من بروتونين بدون أي نيوترونات. وفقاً للحسابات النظرية، كان من الممكن أن يكون نظير هيليوم-2 أكثر ثباتاً لو كان التآثر القوي أكبر بـ 2%، وذلك رغم اضمحلال بيتا إلى ديوتيريوم.[1] تعود عدم الثباتية في نظير الهيليوم-2 إلى تأثير لف مغزلي-لف مغزلي المتبادل (Spin-Spin Interaction) في طاقة النواة وإلى مبدأ استبعاد باولي والذي يجبر البروتونين أن يكون لهما لف مغزلي معاكس مما يعطي ثنائي البروتون طاقة ارتباط نووية سالبة.[2]
في عام 2000 تمكن فريق من العلماء في مختبر أوك ردج الوطني من تتبع نمط جديد من الاضمحلال النووي بحيث أن النواة المضمحلة تتخلى عن بروتونين بنفس الوقت وذلك من خلال قذف حزمة من أيونات الفلور على هدف عالي البروتونات لتشكيل 18Ne والذي بدوره اضمحل إلى أكسجين وبروتونين، ومن المعتقد أن نواة 2He هي الصادرة.[3][4]
لكن أكبر دليل على وجود النظير هيليوم-2 جرى عام 2008 في المعهد الوطني للفيزياء النووية (Istituto Nazionale di Fisica Nucleare) في إيطاليا.[5][6] في هذه التجربة جرى قذف أيونات 20Ne على صفيحة من البيريليوم، والناتج 18Ne جرى صدمه بصفيحة من الرصاص مما أدى إلى تهيجه إلى حالة غير مستقرة تؤدي بالنهاية إلى اضمحلاله إلى أكسجين وبروتونين صادرين بنفس الاتجاه خلال أقل من واحد على بليون من الثانية قبل تفككه إلى بروتونين منفصلين.
هيليوم-3
عدليتألف نظير الهيليوم-3 من بروتونين اثنين ونيوترون واحد وهو نظير غير مشع. تدعى نواة النظير الهيليوم-3 3He باسم هيليون Helion. توجد من النظير هيليوم-3 كميات ضئيلة في الكرة الأرضية، بمعدل ذرة 3He واحدة مقابل مليون من 4He في الغلاف الجوي.[7] وهي موجودة منذ تشكل الأرض على الرغم من كون البعض منها قد هبط للأرض مع الغبار الكوني.[8] إن نسبة الهيليوم-3 في الوسط بين النجمي أعلى بحوالي مئة مرة منها على الأرض.[9] تنتج كميات ضئيلة من هذا النظير من اضمحلال بيتا لنظير الهيدروجين-3 تريتيوم.[10]
يغلي الهيليوم-3 عند 3.19 كلفن مقارنة مع 4.23 كلفن للهيليوم-4، والنقطة الحرجة له أقل من 3.35 كلفن مقارنة مع 5.2 للهيليوم-4. للهيليوم-3 كثافة أقل من نصف كثافة الهيليوم-4 عند نقطة الغليان، 59 غرام على الليتر مقارنة مع 125 غرام على الليتر عند ضغط مقداره 1 جو. بشكل مماثل فإن حرارة التبخر الكامنة للهيليوم-3 أقل بشكل كبير من نظيرتها للهيليوم-4، 0.026 كيلوجول لكل مول و 0.0829 كيلوجول لكل مول على الترتيب.[11]
إن مزيج من كميتين متساويين من 3He و 4He السائل تحت 0.8 كلفن سينفصل إلى طبقتين غير مزوجتين وذلك نتيجة لتباين الإحصاءات الكمومية quantum statistics لهما، حيث أن 4He عبارة عن بوزون في حين أن 3He فرميون.[12] يستفاد من خاصة عدم امتزاج هذين النظيرين في ثلاجة التمديد (Dilution refrigerator) حيث يمكن استخدام هذا التطبيق للحصول على درجات حرارة بحدود بضعة ميلي كلفن.[13]
يستخدم الهيليوم-3 في تجهيز كاشف النيوترون حيث أن مقطعه العرضي للامتصاص مرتفع لحزمة النيوترونات. يحول النيوترون من خلال التفاعل النووي إلى التريتيوم والبروتيوم:
- n + 3He → 3H + 1H + 0.764 MeV
هيليوم-4
عدليعد النظير 4He هيليوم-4 أكثر نظائر الهيليوم ثباتاً ووفرة، حيث يشكل 99.99986% من الهيليوم على الأرض. يتألف هذا النظير من بروتونين اثنين ونيوترونين اثنين، وذلك بتركيب مماثل لجسيمات ألفا. يمنح هذا الترتيب ثباتية كبيرة لأن االنويات مرتبة بغلاف نووي مكتمل.
يعد اضمحلال ألفا للعناصر الثقيلة في القشرة الأرضية المصدر الرئيسي للنظير هيليوم-4 في الأرض. بالمقابل، فإن هذا النظير ينتج في الكون من الاندماج النووي في النجوم.
نقطة غليان ها النظير تبلغ 4.2 كلفن، وتعد بذلك واحدة من أقل القيم المعروفة للعناصر. عندما يبرّد الهيليوم-4 إلى 2.17 كلفن يتحول إلى مائع فائق له خصائص مميزة، فعلى سبيل المثال، في حال وضعه في إناء مفتوح يقوم النظير هيليوم-4 فائق الميوعة بتشكيل طبقة رقيقة (فيلم) تتسلق جدران الوعاء وتفيض على أطرافه. تدعى هذه الظاهرة برقاقة رولن (Rollin film). هذه الظاهرة الغريبة هي نتيجة لمعادلة كلاوزيوس-كلابيرون ولا يمكن تفسيرها بالنموذج الحالي للميكانيكا كلاسيكية إنما فقط من خلال ميكانيكا الكم. يعد هذا المثال خير تمثيل لتكاثف بوز-أينشتاين والذي يحدث فقط لمجموعة من البوزونات.
نظائر الهيليوم الأثقل
عدلكل نظائر الهيليوم الأثقل لها هي مصطنعة غير ثابتة وتضمحل بعمر نصف أقل من ثانية واحدة. تصطنع هذه النظائر عادة في معجل جسيمات.
أقل هذه النظائر عمراً هو هيليوم-5 بنصف عمر 7.6×10−22. الهيليوم-6 يضمحل بإصدار جسيم بيتا وله عمر نصف مقداره 0.8 ثانية. النظير هيليوم-7 يصدر أيضاً جسيم بيتا بالإضافة إلى أشعة غاما. يعد النظير هيليوم-8 أكثر نظائر الهيليوم الثقيلة دراسةً. يعتقد أن للنظير هيليوم-8 أن له نواة هيليوم-4 عادية محاطة بأربع نيوترونات مشكلة ما يسنى نواة هالو (Halo nucleus). على الرغم من أن للنظير هيليوم-10 لديه عدد سحري إلا أن له عمر نصف قصير جداً.[14]
جدول النظائر
عدل| الرمز | Z(ب) | N(ن) | كتلة النظير (u) | عمر النصف | نمط الاضمحلال[15] |
ناتج الاضمحلال[n 1] |
لف مغزلي |
تركيب النظائر التمثيلي (كسر مولي) |
مجال التفاوت الطبيعي (كسر مولي) |
|---|---|---|---|---|---|---|---|---|---|
| 2He [n 2] | 2 | 0 | 2.015894 | 0 ثانية | > p 99.99% | 2 1H | 0+(#) | ||
| < β+ 0.01% | 2H | ||||||||
| 3He [n 3] | 2 | 1 | 3.0160293191 | مستقر[n 4] | 1/2+ | 1.34×10−6 | < 4.1×10−5 | ||
| 4He [n 3] | 2 | 2 | 4.00260325415 | مستقر | 0+ | 0.99999866 | 0.999959-
1 | ||
| 5He | 2 | 3 | 5.01222 | 700×10−24 ثانية | n | 4He | 3/2- | ||
| 6He [n 5] | 2 | 4 | 6.0188891 | 806.7 ميلي ثانية | β- 99.99% | 6Li | 0+ | ||
| β-انشطار (2.8×10−4%) | 4He ، 2H | ||||||||
| 7He | 2 | 5 | 7.028021 | 2.9×10−21 ثانية [159 كيلو إلكترون فولت] |
n | 6He | (3/2)- | ||
| 8He [n 6] | 2 | 6 | 8.033922 | 119.0 ميلي ثانية | β- 83.1% | 8Li | 0+ | ||
| β-,n 16.0% | 7Li | ||||||||
| β-, انشطار 0.09% | 5He ، 3H | ||||||||
| 9He | 2 | 7 | 9.04395 | 7×10−21 ثانية | n | 8He | 1/2(-#) | ||
| 10He | 2 | 8 | 10.05240 | 2.7×10−21 ثانية | 2n | 8He | 0+ | ||
المراجع
عدل- ^ R. A. W. Bradford, J. Astrophys. Astr. (2009) 30, 119–131 The Effect of Hypothetical Diproton Stability on the Universe نسخة محفوظة 07 مايو 2016 على موقع واي باك مشين.
- ^ Nuclear Physics in a Nutshell, C. A. Bertulani, Princeton University Press, Princeton, NJ, 2007, Chapter 1, ISBN 978-0-691-12505-3.
- ^ Physicists discover new kind of radioactivity نسخة محفوظة 23 أبريل 2011 على موقع واي باك مشين., in physicsworld.comOct 24, 2000 نسخة محفوظة 23 أبريل 2011 على موقع واي باك مشين.
- ^ Decay of a Resonance in 18Ne by the Simultaneous Emission of Two Protons, Physical Review Letters vol. 86, pp. 43-46 (2001), by J. Gómez del Campo, A. Galindo-Uribarri et al.
- ^ "New Form of Artificial Radioactivity" Inside Physics Research—Science News Update Number 865 #2, May 29, 2008 by Phil Schewe [وصلة مكسورة] نسخة محفوظة 5 مايو 2013 على موقع واي باك مشين.
- ^ G. Raciti et al., Physical Review Letters 100, 195203–06 (2008) "Experimental Evidence of 2He Decay from 18Ne Excited States"
- ^ J. Emsley (2001). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ص. 178. ISBN:0-19-850340-7.
- ^ "Helium Fundamentals". مؤرشف من الأصل في 2018-07-12.
- ^
G. N. Zastenker؛ وآخرون (2002). "Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements". Astrophysics. ج. 45 ع. 2: 131–142. Bibcode:2002Ap.....45..131Z. DOI:10.1023/A:1016057812964. مؤرشف من الأصل في 2014-04-07.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) - ^ K. L. Barbalace. "Periodic Table of Elements: Li—Lithium". EnvironmentalChemistry.com. مؤرشف من الأصل في 2012-05-27. اطلع عليه بتاريخ 2010-09-13.
{{استشهاد ويب}}: الوسيط|تاريخ أرشيف=و|تاريخ-الأرشيف=تكرر أكثر من مرة (مساعدة) والوسيط|مسار أرشيف=و|مسار-الأرشيف=تكرر أكثر من مرة (مساعدة) - ^ Teragon's Summary of Cryogen Properties Teragon Research, 2005 نسخة محفوظة 09 يوليو 2017 على موقع واي باك مشين.
- ^ The Encyclopedia of the Chemical Elements. ص. 264.
- ^ Dilution Refrigeration. cern.ch نسخة محفوظة 22 مارس 2020 على موقع واي باك مشين.
- ^ Clifford A. Hampel (1968). The Encyclopedia of the Chemical Elements. Reinhold Book Corporation. ص. 260. ISBN:0278916430.
- ^ Universal Nuclide Chart نسخة محفوظة 19 فبراير 2017 على موقع واي باك مشين.