بورازين
مركب كيميائي
(بالتحويل من Borazine)
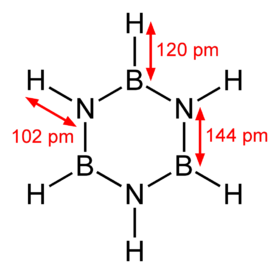
بورازين مركب كيميائي حلقي له الصيغة B3N3H6 ، ويتألف من العناصر البورون، والنيتروجين، والهيدروجين، ويكون على شكل سائل عديم اللون. حضر المركب لأول مرة عام 1926 من قبل الكيميائي الألماني Alfred Stock ألفرد شتوك.[3]
| بورازين | |
|---|---|
| الاسم النظامي (IUPAC) | |
بورازين |
|
| أسماء أخرى | |
حلقي ثلاثي بورازان |
|
| المعرفات | |
| رقم CAS | 6569-51-3 |
| بوب كيم | 138768[1] |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | B3N3H6 |
| الكتلة المولية | 80.50 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.81 غ/سم3 |
| نقطة الانصهار | - 58 °س |
| نقطة الغليان | 55 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الخواص
عدل- نتيجة وجود زوج إلكتروني حر على ذرة النيتروجين فإن المركب يشابه في شكله حلقة البنزين، وع ذلك فإن المركب لا يتمتع بصفة العطرية. بسبب هذا التشايه اقترح الكيميائي الألماني نيلز فيبرغ تسمية البنزين اللاعضوي، ولذلك فإن للبورازين اسم آخر هو البورازول.
- يتفكك مركب البورازين بالتماس مع الماء إلى حمض البوريك والأمونياك والهيدروجين.
التحضير
عدليحضر مركب البورازين من تفاعل ثنائي البوران مع الأمونياك بنسبة 2:1 بين درجتي الحرارة 250–300 °س بمردود 50%.
- 3B2H6 + 6NH3 → 2B3H6N3 + 12H2
هناك طريقة أخرى بمردود أفضل وهي من تفاعل بورهيدريد الليثيوم مع كلوريد الأمونيوم حسب المعادلة:
- 3LiBH4 + 3NH4Cl → B3H6N3 + 3LiCl + 9H2
الاستخدامات
عدليستخدم مركب البيرازين ومشتقاته بشكل رئيسي لتحضير خزف نتريد البورون.
طالع أيضاً
عدلالمراجع
عدلفي كومنز صور وملفات عن Borazine.