نظير (كيمياء)
نظائر العناصر الكيميائية هي ذرات لنفس العنصر الكيميائي لها نفس العدد الذري ولكنها تختلف في الكتلة الذرية بسبب اختلاف عدد النيوترونات.[1][2][3] ولا تختلف الخواص الكيميائية للذرة ونظيرها، ذلك لأن الخواص الكيميائية للذرة تعتمد على عدد البروتونات في النواة وبالتالي على عدد الإلكترونات التي تدور في الغلاف النووي وتوزيعها. الإلكترونات هي التي تشترك في التفاعلات الكيميائية. أما الخواص الفيزيائية فهي تختلف لكلاهما اختلافا كبيرا حيث تعتمد على عدد البروتونات والنيوترونات وتوزيعهما في النواة، وهم يشتركون فيما يسمى تفاعلات نووية. فمثلاً إذا نظرنا إلى ذرة الكربون-12 وهي تحتوي على 6 بروتونات و 6 نيوترونات في نواتها فهي مستقرة (خاصة فيزيائية). أما الكربون-14 فتحتوي نواته على 6 بروتونات و 8 نيوترونات وهو نظير مشع أي ذو نشاط إشعاعي (خاصة فيزيائية) ويتحلل من ذاته عن طريق تحلل بيتا.
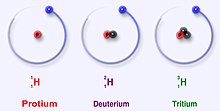
عند تطبيق التسمية العلمية فإن النظير (نوكليد Nuclide) محدد باسم العنصر متبوعا بشرطة ثم عدد النوكليونات (البروتونات والنيوترونات) الموجودة في نواة الذرة. أمثلة : الهيليوم-3 وتحتوي نواته على برتونين و 1 نيوترون،
كربون-12 وتحتوي نواته على 6 بروتونات و 6 نيوترونات ،
كربون-14 وتحتوي نواته على 6 بروتونات و8 نيوترونات،
حديد-57 وتحتوي نواته على 26 بروتونات و 31 من النيوترونات،
ورمز يورانيوم-238 ويحتوي في نواته على 92 بروتون والباقي (نيوترونات).
وعند استخدام الاختصارات فيتم وضع رقم النوكليونات أعلى رمز العنصر كالآتي: (3He, 12C, 14C, 57Fe, 238U)
اختلاف الخواص بين النظائر
عدلفي الذرة المتعادلة، عدد الإلكترونات يساوى عدد البروتونات. وعلى هذا فإن النظائر المختلفة يكون لها نفس عدد الإلكترونات ونفس البنية الإلكترونية. ونظرا لأن تصرف الذرة كيميائيا يتم تحديده بالتركيب الإلكتروني، فإن النظائر تقريبا تسلك نفس السلوك الكيميائي. الاستثناء الأساسي أنه نظرا لوجود اختلاف في كتلتها، فإن النظائر الثقيلة تميل لأن تتفاعل بصورة أبطأ من النظائر الأخف لنفس العنصر.(تسمى هذه الظاهرة تأثير حركة النظائر).
ويلاحظ تأثير الكتلة للهيدروجين (1H) بالمقارنة بالديوتريوم (2H), نظرا لأن الديوتريوم له ضعف كتلة الهيدروجين. حيث يحتوي الهيدروجين على 1 بروتون بينما تحتوي نواة الديوتريوم على 1 بروتون و 1 نيوترون. ورغم ذلك فتظل خواصهما الكيميائية متماثلة، ولكن يختلفان في سرعة الانتشار. أما بالنسبة للعناصر الأثقل فإن تأثير الكتلة النسبي بين النظائر يقل ويكاد ينعدم كلما زاد ثقل العنصر.
وبالنسبة إلى جزيئين يختلفان فقط احتواء أحدهما على ذرة معينة والأخر يحتوي على نظير تلك الذرة، سيكون لهما تقريبا نفس نفس التركيب الإلكتروني، وعلى هذا سيكون لهما خواص فيزيائية وكيميائية متشابهه. النظم الاهتزازية للجزيء تعتمد على شكل الجزيء (فمثلا جزيئ ثاني أكسيد الكربون شكله مستقيم O-C-O وجزيئ الماء ذو زاوية مقدارها 120 درجة تقريبا H-O-H [مثلث الشكل]) ويعتمد تردد الاهزازات على كتلة الذرات المكونة له وشدة الترابط الكيميائي. وبالتالى فإن هاذين النظيرين سيكون لكل منهما نمط اهتزازي مختلف قليلا عن النمط الاهتزازي للآخر، ويظهر ذلك عند تعيين التردد الاهتزازي لكل منهما. حيث أن النمط الاهتزازي يسمح للجزيء امتصاص فوتونا ذو طاقة ملائمة لطاقة الاهتزاز (الكمومية) بعينها. ويتبع ذلك أن يكون للنظرين خواصا ضوئية مختلفة في نطاق الأشعة تحت الحمراء.
خواص نووية
عدلبالرغم من أن النظائر لها تقريبا نفس الخواص الإلكترونية والكيميائية حيث تعتمد هذه الخواص على عدد الإلكترونات في الغلاف الذري، فإن سلوك نواة العنصر ونواة النظير يختلف تماما (خصائص فيزيائية). تتكون النواة الذرية من بروتونات ونيوترونات مرتبطة معا بقوى نووية قوية. ونظرا لأن البروتونات لها شحنة موجبة، فإنها تميل إلى التنافر عن بعضها البعض، ولكن قوة التآثر القوي أقوى من قوة التنافر الكهربائية الناشئة عن تماثل الشحنات طبقا لقانون كولوم. وتقوم النيوترونات بتهدئة قوى التنافر بين الشحنات الموجبة، مما يقلل من التنافر الكهرستاتيكي وتساعد على استقرار النواة. وبزيادة عدد البروتونات في النواة تزداد الحاجة لنيوترونات للعمل على تماسك النواة. فمثلا، على الرغم من أن نسبة نيوترون / بروتون في 3He هي 1 / 2، فإن نسبة نيوترون / بروتون في اليورانيوم 238U أكبر وتصل إلى 3 / 2. (تحتوي نواة اليورانيوم على 92 بروتون والباقي نيوترونات = 238 - 92 = 146 نيوترون) (انظر نموذج القطرة). وفي حالة وجود نيوترونات أقل أو أكثر من حدود معينة، فإن النواة تكون غير مستقرة، وتصبح النواة ذات نشاط إشعاعي وهو وسيلة تتخذها النواة للوصول إلى حالة استقرار.
التواجد في الطبيعة
عدليمكن لعدة نظائر لنفس العنصر أن تتواجد في الطبيعة فيكون منها النظير المستقر ونظائر غير مستقرة وذلك بحسب عدد النيوترونات والبروترونات في أنويتها. ونسبة تواجد نظائر لعنصر ما طبيعيا يعتمد على خواصه المتعلقة بالتحلل النووي. وتوجد أنوية (نوكليدات) مستقرة للعنصر، وقد توجد أنوية له غير مستقرة لعدم ملاءمة عدد النيوترونات فيها لعدد البروتونات. وبعملية النشاط الإشعاعي الذي تكون عن طريق تحلل ألفا أو تحلل بيتا أو كلاهما والتي تؤديها النواة طبيعيا فهي تحاول الوصول إلى حالة الاستقرار. التحلل النووي هو عملية لتحويل بعض مكونات النواة من بروتونات مثلا إلى نيوترونات لتصبح مستقرة أو تحويل أحد النيوترونات إلى بروتون لتصبح مستقرة، أو كما في تحلل ألفا تطرد النواة الغير مستقرة بروتونين ونيوترونين (جسيم ألفا) وتصبح مستقرة. ويتميز كل نشاط إشعاعي بما يسمى بعمر النصف.
وبالتوافق مع علم الكون، فإن كل النوكليدات الثقيلة بخلاف نظائر الهيدروجين والهيليوم نتجت في النجوم والسوبرنوفا. ويكون تواجدها الطبيعي ناتجا من الكميات الناتجة أثناء تلك العمليات الكونية، وأيضاً توزيعها في المجرة، ومعدلات إضمحلالها. وبعد الاندماج المبدئي للنظام الشمسي، توزعت النظائر طبقا لكتلها (شاهد أصل النظام الشمسي). يختلف تركيب نظائر العناصر على كل كوكب، مما يجعل من الممكن تحديد أصل النيازك ومن أين أتت.
تطبيقات النظائر
عدلوكما قال العالمان الفرونكو زينوميك وكادار الفونسو بيراز في مأدبة عشاء في ألمانيا فان هناك كثيرا من التطبيقات التي يتم استخدام الخواص المختلفة للنظائر فيها وكذلك هناك عدة احتمالات فبالتالي هناك عدة نظائر لأي عنصر مهما كان وذلك الاختلاف يكون في عدد النيوترونات.
كما أن هناك تطبيقات أخرى منها استخدامها في مجال علاج امراض السرطان باستخدام النظائر المشعة للقضاء على الخلايا السرطانية.
استخدام الخواص النووية
عدل- تعتمد كثير من تقنيات المطياف على الخواص النووية المتفردة للنظائر. فمثلا " مطياف الرنين المغناطيسي النووي " NMR " يتم استخدامه فقط للنظائر التي لها قيمة دوران غير صفرية. وأكثر النظائر استخداما مع مطياف رنين نووي مغناطيسي 1H، 2D، 13C، 31P.
- مطياف موس باوير يعتمد أيضا على الانتقالات النووية لنظائر معينة مثل 57Fe.
- النوكليدات المشعة لها استخدامات مهمة في الطب (علاج السرطان) وفي الكيمياء . كما أن تطوير وبناء الأسلحة النووية يتطلب كميات كبيرة من نظير معين لليورانيوم، وهو اليورانيوم-235 أو البلوتونيوم-239 وتتطلب طرق معقدة لفصلها وتنقيتها. يعتبر فصل النظائر تحديا تقنيا معقدا، يستخدم فيه جهاز المركزية الطاردة أو طريقة النفاذية في غشاء.
وتستخدم النظائر المشعة في كشف عيوب الصناعة وفي الأبحاث العلمية مثل اثبات العلماء ان الاكسجين الخارج من النبات مصدره الماء وليس ثانى اكسيد الكربون عن طريق استخدام نظير الاكسجين المشع وأيضاً تستخدم النظائر في الزراعة في قتل الافات الزراعية وتحسين السلالات النباتية.
اقرأ أيضاً
عدل- نوكليون
- جدول النظائر المقسم.
- جدول النظائر الكامل.
- قائمة جسيمات.
- الكيمياء الكهربية للنظير .
- النظائر هي عناصر لها نفس عدد البروتونات.
- متعادلات النيوترونات هي نيوكليدات لها نفس عدد النيوترونات.
- أيسوبار هي النيوكليدات لها نفس عدد الكتلة، أي مجموع البروتونات والنيوترونات.
- المتشابهات النووية هي حالات مثارة مختلفة لنفس نوع النيوكليدات. الشكل الانتقالي من أحد النظائر للأخر يصاحبه انبعاث أو امتصاص أشعة غاما، أو عملية التحول الداخلي. (لا يجب الخلط بين ذلك وبين المتشابهات الكيميائية).
- قائمة رموز النظائر
مراجع
عدل- ^ "معلومات عن نظير (كيمياء) على موقع jstor.org". jstor.org. مؤرشف من الأصل في 2019-05-25.
- ^ "معلومات عن نظير (كيمياء) على موقع esu.com.ua". esu.com.ua. مؤرشف من الأصل في 2017-09-03.
- ^ "معلومات عن نظير (كيمياء) على موقع nytimes.com". nytimes.com. مؤرشف من الأصل في 2018-05-02.