متلازمة كفر راكب
متلازمة كفر ركب (بالإنجليزية: Kufor–Rakeb syndrome) هي اضطراب وراثي جسمي متنحي لظهور الأحداث المعروف أيضًا بمرض باركنسون -9 (PARK9).[4] سميت على اسم كفر ركب في اربد، الأردن.[5] تم التعرف على متلازمة كفر ركب لأول مرة في هذه المنطقة في الأردن مع 5 أطفال أردنيين من الزوجين الذين يعانون من صلابة، ووجه يشبه القناع، وبطء الحركة.[6] تم وصف المرض لأول مرة في عام 1994 من قبل نجم الدين وآخرون.[6] رقم OMIM هو 606693.[6]
| متلازمة كفر راكب | |
|---|---|
| Kufor–Rakeb syndrome | |
نمط وراثة متلازمة كفر ركب
| |
| معلومات عامة | |
| من أنواع | التنكس العصبي المصاحب لتراكم الحديد في الدماغ[1]، واضطراب جيني[2]، واضطراب صبغي جسدي متنحي [3] |
| تعديل مصدري - تعديل | |
تم الإبلاغ عن إصابة أقل من 50 فردًا بـ KRS.[7] عادةً ما يحدث ظهور سريع للأعراض بين سن 12 و 16 عامًا.[8] من المهم إجراء الاختبارات الجينية لفحص أفراد الأسرة، بحيث يمكن اكتشاف المرض مبكرًا ويمكن التحكم في الأعراض.[7]
ترتبط الطفرات الجينية ATP13A2 بمتلازمة كفر راكب.[9] تم تحديد طفرة ATP13A2 لأول مرة في عام 2010.[10] تم تحديد هذه المتلازمة على أنها طفرة مركبة متغايرة الزيجوت heterozygous أو متماثلة الزايغوت(homozygous ) في جين ATP13A2.[8] توجد هذه الطفرة في الكروموسوم 1 ورموز لقاعدة الليزوزومات من النوع 5 ATPase.[6] تم التعرف على أن المرضى لديهم حديد في العقد القاعدية (basal ganglia).[9]
العلامات والأعراض
عدلبالنسبة لمعظم الأفراد المصابين بمتلازمة كفر راكب، تبدأ الأعراض في الظهور خلال أول 10 إلى 20 عامًا من العمر. متلازمة كفر راكب هي اضطراب تنكسي عصبي، لذلك تميل شدة الأعراض إلى التقدم بمرور الوقت.[11] يمكن تقسيم أعراض متلازمة كفر راكب إلى فئتين رئيسيتين: الأعراض الحركية (الأعراض التي تؤثر على الحركة) والأعراض غير الحركية (الأعراض التي لا تؤثر على الحركة).
تشمل الأعراض الحركية:
- مرض باركنسون اللانمطي الذي يظهر عند الأحداث (PARK9)[8]
- بطء الحركة (تباطؤ الحركات)
- رعاش في الذقن واللسان وفي بعض الحالات الذراعين
- الاستعلاء
- عدم الاستقرار الوضعي
- شلل النظرة فوق النووية (عدم القدرة على تحريك العين في الاتجاه الرأسي)[12]
- الشلل النصفي (شلل جزئي أو كلي في الساقين)[13]
- الرنح (فقدان تنسيق الحركات)[11]
- خلل التوتر العضلي (تقلصات عضلية لا إرادية تؤدي إلى أوضاع غير طبيعية)[11]
- خلل الحركة (الحركات اللاإرادية) وفرط المنعكسات (زيادة ردود الفعل)
- رمع عضلي صغير في الوجه الصليبي (تقلصات عضلية لا إرادية للأصابع والوجه والممر في مؤخرة الفم المؤدية إلى البلعوم) تشمل الأعراض غير الحركية:[11]
- الإعاقة الذهنية المعرفية وصعوبة التعلم[10]
- مرض عقلي
- الهلوسة البصرية والسمعية
- القلق الشديد ونوبات الذعر
علم الوراثة
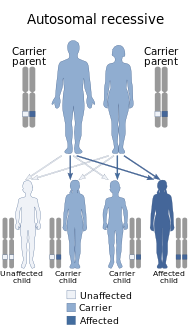
عدلترتبط متلازمة كفر راكب بطفرات في جين ATP13A2.[14] نمط الوراثة لـ KRS متنحي.[15] إذا كان لدى حامل ذكر وأنثى أليل متنحي واحد لطفرة جينية ATP13A2 وأليل واحد سائد لجين ATP13A2 طفل، فهناك احتمال بنسبة 25% أن يكون الطفل مصابًا بـ KRS، واحتمال أن يكون الطفل حاملًا بنسبة 50% بالنسبة لـ KRS، وفرصة 25% أن الطفل ليس لديه KRS.[16]
يقع الجين ATP13A2 على الكروموسوم 1 (1p36.13).[17] يمثل الجين ATP13A2 الموضع 36 على الذراع p، وهو الذراع القصير، والنطاق الفرعي 13 الذي يتم تحديده بالعلامة العشرية.[18]
الطفرات الجينية ATP13A2 المرتبطة بـ KRS هي أشكال مبتورة وتسبب عدم استقرار البروتين مع فقدان الوظيفة.[19] تسبب الطفرة المقطوعة تحديد موقع ATP13A2 الخاطئ للشبكة الإندوبلازمية حيث يحللها البروتياز من خلال مسار التدهور المرتبط بـ ER (ERAD).[15] ترتبط الطفرات الخاطئة متغايرة الزيجوت ومتماثلة اللواقح في ATP13A2 ببداية مرض باركنسون.[15] الطفرات المركبة متغايرة الزيجوت ومتماثلة اللواقح في موضوعات KRS في عائلات من الصين والأردن وباكستان وتشيلي وأفغانستان، والتي تسبب متغيرات التضفير أو طفرات الانزياح الإطاري التي تقطع ATP13A2.[15] ارتبطت الطفرات في جين ATP13A2 أيضًا بالشلل النصفي التشنجي الوراثي، أو الشلل الرعاش غير المضاعف المبكر - أو المتأخر الظهور وداء الليفوفوسينيس العصبوني.[20]
تشخبص
عدليتطلب تشخيص متلازمة كفر ركب تاريخًا مرضيًا واسعًا إلى جانب الفحص البدني والعصبي. يمكن الاشتباه في KRS في الأفراد المصابين بداء باركنسون عند الأحداث في أول 10-20 سنة من العمر. في مرضى KRS، يمكن أن يُظهر التصوير بالرنين المغناطيسي ضمورًا في المخ وتراكمًا للحديد في العقد القاعدية. يشار إلى تراكم الحديد هذا باسم NBIA، أو التنكس العصبي مع تراكم الحديد في الدماغ، وهو عرض فريد لمجموعة معقدة من الأمراض التنكسية العصبية الموروثة مثل KRS، والتي تتميز بتراكم الحديد في العقد القاعدية.[21] بالإضافة إلى ذلك، يمكن للفحص الجيني من خلال تحليل التسلسل أن يسمح بالتشخيص النهائي للمرض عن طريق تحديد الطفرات في جين ATP13A2، وهو جين مرتبط ارتباطًا وثيقًا بمتلازمة كفر راكب.[13]
إدارة
عدلنظرًا لعدم وجود علاج لمتلازمة كفر راكب، فإن العلاج يركز على إدارة الأعراض وتحسين نوعية حياة الأفراد المصابين. يتشابه علاج متلازمة كوفور راكب مع علاج مرض باركنسون النموذجي ويتكون أساسًا من مزيج من دوائين يسميان ليفودوبا (L-DOPA) وكاربيدوبا.[22] الهدف من هذا الدواء هو تخفيف الأعراض الحركية عن طريق زيادة تركيز الدوبامين في الجهاز العصبي. يمكن أيضًا استخدام ناهضات مستقبلات الدوبامين. Trihexylphenidyl والأمانتادين ويمكن أيضا أن توصف، خاصة في الحالات التي يكون فيها الدوبامين دواء غير فعال أو التسامح. يمكن استخدام توكسين البوتولينوم (البوتوكس) لعلاج خلل التوتر العضلي.[13] يتم استخدام الدواء فقط للسيطرة على أعراض المرض (علاج الأعراض) وليس لعلاجه. تتمثل فوائد الأدوية في الغالب في الأعراض الحركية، وليس لها تأثير كبير على الأعراض غير الحركية لـ KRS.[11]
يمكن أيضًا أن يكون العلاج الطبيعي و / أو المهني و / أو النطق من التدخلات المفيدة. خيارات العلاج للأعراض غير الحركية محدودة أكثر.[23] قد يحتاج الأفراد المصابون بمتلازمة كفر راكب أيضًا إلى مساعدة على المشي أو كرسي متحرك. يمكن الإشارة إلى التعليم الخاص، حيث إن الإعاقة الذهنية وصعوبات التعلم شائعة فيKRS. قد تكون مساعدة مقدمي الرعاية أو المهنيين الصحيين ضرورية أيضًا لأداء أنشطة الحياة اليومية، اعتمادًا على شدة المرض. يجب تقديم خدمات الاستشارة الوراثية للعائلات المتضررة.
علم الأوبئة
عدلتعتبر متلازمة كفر ركب اضطرابًا نادرًا جدًا وتم تشخيصها في أقل من 50 فردًا في الأدب.[24] KRS نادر، لذلك من المحتمل أنه غالبًا ما يتم تشخيصه بشكل أقل وأن معدل الانتشار أعلى مما هو مذكور في الأدبيات.[7] تم تحديد طفرات KRS في عائلات من الصين والأردن وباكستان وتشيلي وأفغانستان.[19]
مراجع
عدل
- ^ Monarch Disease Ontology release 2018-06-29 (ط. 2018-06-29)، 29 يونيو 2018، QID:Q55345445
- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ "Kufor Rakeb disease: autosomal recessive, levodopa-responsive parkinsonism with pyramidal degeneration, supranuclear gaze palsy, and dementia". Movement Disorders. ج. 20 ع. 10: 1264–71. أكتوبر 2005. DOI:10.1002/mds.20511. PMID:15986421.
- ^ "Kufor-Rakeb - NBIA Disorders Association". www.nbiadisorders.org. مؤرشف من الأصل في 2021-12-19. اطلع عليه بتاريخ 2021-04-26.
- ^ ا ب ج د "OMIM Entry - # 606693 - KUFOR-RAKEB SYNDROME; KRS". www.omim.org. مؤرشف من الأصل في 2021-12-14. اطلع عليه بتاريخ 2021-04-26.
- ^ ا ب ج "Kufor Rakeb Syndrome". NORD (National Organization for Rare Disorders) (بالإنجليزية الأمريكية). Archived from the original on 2021-05-01. Retrieved 2021-05-03.
- ^ ا ب ج "OMIM Entry - # 606693 - KUFOR-RAKEB SYNDROME; KRS". www.omim.org. مؤرشف من الأصل في 2023-03-03. اطلع عليه بتاريخ 2021-04-26."OMIM Entry - # 606693 - KUFOR-RAKEB SYNDROME; KRS". www.omim.org. Retrieved 2021-04-26.
- ^ ا ب "Formate assay in body fluids: application in methanol poisoning". Biochemical Medicine. ج. 13 ع. 2: 117–26. يونيو 1975. DOI:10.1016/0006-2944(75)90147-7. PMID:1.
- ^ ا ب "Kufor-Rakeb - NBIA Disorders Association". www.nbiadisorders.org. مؤرشف من الأصل في 2022-12-10. اطلع عليه بتاريخ 2021-04-26."Kufor-Rakeb - NBIA Disorders Association". www.nbiadisorders.org. Retrieved 2021-04-26.
- ^ ا ب ج د ه "Kufor Rakeb Syndrome". NORD (National Organization for Rare Disorders) (بالإنجليزية الأمريكية). Archived from the original on 2021-05-01. Retrieved 2021-04-29.
- ^ "Kufor-Rakeb | NBIA" (بالإنجليزية الأمريكية). Archived from the original on 2021-04-26. Retrieved 2021-04-26.
- ^ ا ب ج "Kufor Rakeb Syndrome". NORD (National Organization for Rare Disorders) (بالإنجليزية الأمريكية). Archived from the original on 2022-12-07. Retrieved 2021-04-29."Kufor Rakeb Syndrome". NORD (National Organization for Rare Disorders). Retrieved 2021-04-29.
- ^ "Kufor-Rakeb syndrome - MeSH - NCBI". www.ncbi.nlm.nih.gov. مؤرشف من الأصل في 2021-05-03. اطلع عليه بتاريخ 2021-05-03.
- ^ ا ب ج د "Common pathogenic effects of missense mutations in the P-type ATPase ATP13A2 (PARK9) associated with early-onset parkinsonism". PLOS ONE. ج. 7 ع. 6: e39942. 29 يونيو 2012. Bibcode:2012PLoSO...739942P. DOI:10.1371/journal.pone.0039942. PMID:22768177.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Kufor-Rakeb | NBIA" (بالإنجليزية الأمريكية). Archived from the original on 2022-09-22. Retrieved 2021-04-26."Kufor-Rakeb | NBIA". Retrieved 2021-04-26.
- ^ "OMIM Entry * 610513 - ATPase 13A2; ATP13A2". omim.org (بالإنجليزية الأمريكية). Archived from the original on 2021-05-03. Retrieved 2021-05-03.
- ^ "How do geneticists indicate the location of a gene?: MedlinePlus Genetics". medlineplus.gov (بالإنجليزية). Archived from the original on 2021-12-27. Retrieved 2021-05-03.
- ^ ا ب "Common pathogenic effects of missense mutations in the P-type ATPase ATP13A2 (PARK9) associated with early-onset parkinsonism". PLOS ONE. ج. 7 ع. 6: e39942. 29 يونيو 2012. Bibcode:2012PLoSO...739942P. DOI:10.1371/journal.pone.0039942. PMID:22768177.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)صيانة الاستشهاد: دوي مجاني غير معلم (link)Podhajska A, Musso A, Trancikova A, Stafa K, Moser R, Sonnay S, et al. (2012-06-29). "Common pathogenic effects of missense mutations in the P-type ATPase ATP13A2 (PARK9) associated with early-onset parkinsonism". PLOS ONE. 7 (6): e39942. Bibcode:2012PLoSO...739942P. doi:10.1371/journal.pone.0039942. PMC 3386943. PMID 22768177. - ^ "Genetic and phenotypic characterization of complex hereditary spastic paraplegia". Brain. ج. 139 ع. Pt 7: 1904–18. يوليو 2016. DOI:10.1093/brain/aww111. PMID:27217339.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Salomão، Rubens Paulo Araújo؛ Pedroso، José Luiz؛ Gama، Maria Thereza Drumond؛ Dutra، Lívia Almeida؛ Maciel، Ricardo Horta؛ Godeiro-Junior، Clécio؛ Chien، Hsin Fen؛ Teive، Hélio A. G.؛ Cardoso، Francisco (يوليو 2016). "A diagnostic approach for neurodegeneration with brain iron accumulation: clinical features, genetics and brain imaging". Arquivos de Neuro-Psiquiatria. ج. 74 ع. 7: 587–596. DOI:10.1590/0004-282X20160080. ISSN:1678-4227. PMID:27487380.
- ^ "Levodopa and Carbidopa: MedlinePlus Drug Information". medlineplus.gov (بالإنجليزية). Archived from the original on 2021-11-17. Retrieved 2021-05-02.
- ^ "Physical Therapy for Parkinson's Disease". www.hopkinsmedicine.org (بالإنجليزية). Archived from the original on 2021-05-05. Retrieved 2021-05-02.
- ^ "Kufor Rakeb Syndrome". NORD (National Organization for Rare Disorders) (بالإنجليزية الأمريكية). Archived from the original on 2022-12-07. Retrieved 2021-05-03."Kufor Rakeb Syndrome". NORD (National Organization for Rare Disorders). Retrieved 2021-05-03.