نموذج بور
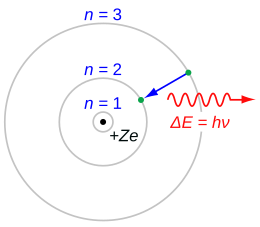
نموذج بور (بالإنجليزية: Bohr model) نموذج في الفيزياء الذرية يصوّر الذرة كنواة صغيرة موجبة الشحنة محاطة بالإلكترونات الموجودة في مدارات - وذلك مثل النظام الشمسي. ونظرا لسهولة هذا النموذج فإنه لا يزال يستخدم كمقدمة لدارسي ميكانيكا الكم.سمي هذا النموذج «نموذج بور» على اسم العالم الفيزيائي الكبير نيلز بور الذي اقترحه لتمثيل ذرة الهيدروجين بحيث يتطابق هذا النموذج مع خطوط الطيف المنبعثة من ذرات الهيدروجين ويفسرها.

في أوائل القرن العشرين، أثبتت التجارب التي أجراها إرنست راذرفورد وأخرون أن الذرة تتكون من الكترون سالبة الشحنة تدور في مدارات حول نواة كثيفة وصغيرة وموجبة الشحنة، ولكن ظهرت المشكلة في أن الإلكترونات المشحونة كهربياً عند دورانها تحت تأثير العجلة المركزية تشع طاقة بشكل مستمر فتقل طاقتها وتدور بشكل حلزوني إلى أن تسقط في النواة وقد حددت صيغة لارمور فترة حدوث ذلك بما يقرب من 16 بيكوثانية.[1]
وأبسط أنواع الذرات هي ذرة الهيدروجين، والتي تتكون من بروتون وإلكترون مرتبطان معا بالقوى الكهرستاتيكية. وهذا مخالف لنظام الأرض-الشمس، والذي يتم الارتباط فيه عن طريق قوى الجاذبية.
في نموذج بور يمكن للإلكترونات أن تكون فقط على مسافة محددة من البروتون المرتبطة به. وعند تواجدها في أي مكان أخر فإنه يستلزم فقد طاقة (بالإشعاع الضوئي) وأخيرا يقل نصف قطر دوران الإلكترون حول البروتون حتى تسقط فيه مما يؤدى لتدمير الذرة. وقد كان هناك دعم لهذه النظرية بخطوط الطيف، والتي وضحت أن الإلكترونات التي تدور في مدارات ينبعث منها ضوء في ترددات وطاقات معينة.
وعلى هذا فقد اقترح بور في عام 1913 الآتي:
- تدور الإلكترونات في مدارات دائرية لها طاقات كمية منفصلة حول البروتون تحت تأثير قوة التجاذب لكولوم.
- قوانين الميكانيكا التقليدية لا يمكن تطبيقها عندما يقوم الإلكترون بعمل القفزات بين المدارات المسموح له التواجد فيها، تطبق فقط عند المدارات الثابتة للإلكترون حيث لا يبعث طاقة.[2]
- عندما يقوم إلكترون بعمل قفزة من مدار لأخر فإن فرق الطاقة إما يكتسب أو يفقد بوحدة واحدة كمية من الطاقة (تسمى فوتون)، والذي له طاقة تساوى الفرق بين طاقتى المدارين.
- المدارات المسموحة تعتمد على قيم الكمات المنفصلة للمدار العزم الزاوي طبقا للمعادلة
حيث إلخ، ويسمى عدد كم مداري.
الافتراض رقم (4) ينص على أن أقل مستوى . ينطبق على أقل نصف قطر في ذرة الهيدروجين ويبلغ 0.0529 نانومتر، والذي يعرف بنصف قطر بور. وعندما يتواجد إلكترون في أصغر مدار، فلا يمكن أن يقترب من البروتون لأقل من هذه القيمة.
ولوصف أكثر دقة للذرة راجع ميكانيكا الكم. المعالجة الكاملة من ناحية ميكانيكا الكم للذرة أكثر دقة - ولكنها حسابيا أكثر تعقيدا. واستخدام نموذج بور يمكن أن يعطى نتائج مفيدة بمجهودات أقل. والشيء الذي يجب تذكره ومثل النماذج الأخرى، فإن هذا النموذج يساعد في فهم تركيب الذرة، والتي ليست مجرد نظام شمسي مصغر، ذلك لأنه ثبت أن وصف سلوك الإلكترون في الذرة يتم بواسطة ميكانيكا الكم ولا تفلح الميكانيكا التقليدية في وصف سلوكه.
استنتاج مستويات الطاقة الإلكترونية للهيدروجين
عدلنموذج بور دقيق فقط لنظام يحتوى على إلكترون واحد فقط مثل ذرة الهيدروجين أو الأيون الأحادى للهيليوم. وسيتم استخدام نموذج بور لإستنتاج مستويات الطاقة للهيدروجين.
وسنقوم بالبدء ببيان ثلاثة فروض أولية:
- 1- في عام 1924م إقترح العالم الفرنسي لويس دي برولي أن كل الجسيمات لها طبيعة موجية (انظر ازدواجية موجة-جسيم)، والطول الموجي للإلكترون ، يتناسب مع سرعته كالتالي:
- حيث، هي ثابت بلانك، هي كتلة الإلكترون. ولم يقم بور بعمل هذا الافتراض (والذي يعرف بطول موجة دي برولي) في شكله المشتق الأصلي، لأنه لم يكن قد تم فرضه في هذا الوقت. عموما فإن هذا يسمح بلإفتراض الآتي:
- 2- محيط المدار الذي يدور فيه الإلكترون لابد أن يكون ناتج من ضرب رقم صحيح في قيمة الطول الموجي للإلكترون:
- حيث، نصف قطر المدار الذي يدور فيه الإلكترون، هي رقم صحيح.
- 3- يظل الإلكترون في المدار عن طريق قوة كولوم، وهذه القوى تساوى قوة جذب مركزية:
- حيث , و هي شحنة الإلكترون.
وهذه ثلاث معادلات مع ثلاث معطيات غير معلومة: و و . وبعد حل معادلات هذا النظام نجد معادلة واحدة خاصة بالمجهول نضعها في المعادلة الخاصة بالطاقة الكلية (الطاقة الكلية = طاقة الحركة + طاقة الوضع) للإلكترون:
- وبسبب نظرية فيريال يتم تبسيط الطاقة الكلية لتصبح:
وأخيرا نجد معادلة تعطينا الطاقة للمستويات المختلفة للهيدروجين:
وعلى هذا، يكون أقل مستويات الطاقة للهيدروجين يساوى eV. ومستوى الطاقة التالي يساوى إلكترون فولت، والثالث يساوى إلكترون فولت، وهكذا.
لاحظ أن كل هذه الطاقات أقل من الصفر، وهذا يعنى أن الإلكترون في حالة ارتباط مع البروتون.
الانتقال بين مستويات الطاقة (معادلة ريدبرغ)
عدلعندما ينتقل الإلكترون من مستوى طاقة لمستوى آخر، فإنه يطلق فوتونا (شعاع ضوء ذو طول موجة محدد (كمومي). وباستخدام المعادلة الخاصة بمستويات الطاقة للهيدروجين يمكن تحديد الأطوال الموجية للضوء الذي يمكن أن ينبعث من الهيدروجين.
أولا يتم حساب الطاقة التي تنبعث من الهيدروجين بحساب الفرق بين مستويين من مستويات طاقة الهيدروجين:
- حيث تعنى مستوى الطاقة الأخير، و تعنى مستوى الطاقة المبدئي (بافتراض ان مستوى الطاقة الأخير أقل من المستوى المبدئي).
وحيث ان طاقة الفوتون تساوي:
يكون الطول الموجي للفوتون المنبعث يساوي:
- والذي يعرف ب صيغة ريدبرغ.
وهذه المعادلة كانت معروفة للعلماء الذين قاموا بعمل دراسة للطيف في القرن التاسع عشر، ولكن لم يكن لديهم إثبات نظري للمعادلة حتى قام بور بفرض نظريته.
القصور في نموذج بور
عدلفشل نموذج بور في تفسير الآتى:
- تفسير أطياف العناصر الأثقل من الهيدروجين، فهي بالكاد تفسر الذرات التي لها إلكترون وحيد.
- الفروق النسبية لخطوط الطيف.
- تواجد خطوط طيف البنية الدقيقة.
- تأثير زيمان - والتي تفسر وجود تغير في خطوط الطيف عند وجود مجال مغناطيسي خارجى.
انظر أيضا
عدلالمصادر
عدل- بور، نيلز (1913). تركيب الذرات والجزيئات (الجزء 1 من 3)
- بور، نيلز (1913). تركيب الذرات والجزيئات (الجزء 2) الأنظمة التي تحتوى على نواة وحيدة الإلكترون. Philosophical Magazine 26: 476-502
- بور، نيلز (1913). تركيب الذرات والجزيئات (الجزء 3) Philosophical Magazine 26: 857-875.
- بور، نيلز (1914). طيف الهيليوم والهيدروجين. Nature 92: 231-232.
- Tipler, Paul; Llewellyn, Ralph 2002، الفيزياء الحديثة (الطبعة الرابعة) W. H. Freeman رقم ID=ISBN 0-7167-4345-0
مراجع
عدل- ^ https://web.archive.org/web/20190909221112/http://www.physics.princeton.edu/~mcdonald/examples/orbitdecay.pdf. مؤرشف من الأصل (PDF) في 2019-09-09.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - ^ الفيزياء للعلميين والمهندسين- الفيزياء الحديثة. تأليف: ريموند سيرواي، روبرت بكتر، جون جيويت. ترجمة أ.د: صلاح كامل اللبني. دار المريخ للنشر الرياض. ط: 5 سنة: 1429هـ/ 2008م. ردمك: 6-116-24-9960