بيرين (كيمياء)
تحتاج هذه المقالة إلى الاستشهاد بمصادر إضافية لتحسين وثوقيتها. |
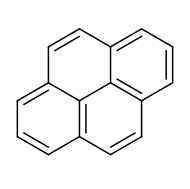
بيرين هو هيدروكربون عطري متعدد الحلقات له الصيغة الكيميائية C16H10، ويكون على شكل بلورات بيضاء عديمة اللون.[3] [4] [5]
| بيرين | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Pyrene |
|
| أسماء أخرى | |
Benzo[def]phenanthrene |
|
| المعرفات | |
| رقم CAS | 129-00-0 |
| بوب كيم (PubChem) | 31423 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C16H10 |
| الكتلة المولية | 202.25 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 1.21 غ/سم3 |
| نقطة الانصهار | 156 °س |
| نقطة الغليان | 404 °س |
| الذوبانية في الماء | 135 مغ/ل ماء (عملياً غير منحل) |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الوفرة الطبيعية
عدليوجد البرين طبيعياً في قطران الفحم، حيث يشكل حوالي 2% وزناً من التركيب. كما ينتج المركب عند عملية الاحتراق غير الكامل للمواد العضوية، فعلى سبيل المثال، تنتج السيارات حوالي 1 ميكروغرام من المركب في كل كيلومتر.[8]
هناك ارتباط بين نسبة الكربون في الكون وبين الهيدروكربونات العطرية متعددة الحلقات، حيث أن أكثر من 20% من الكربون في الكون مترافق ومرتبط في مركبات PAHs، ومنها البيرين.[9]
الخواص
عدليوجد المركب على شكل بلرات بيضاء/عديمة اللون، ذات انحلالية ضعيفة جداً في الماء.
يخضع البيرين للعديد من التفاعلات الكيميائية، منها تفاعل الأكسدة بالكرومات للحصول على مركب بيرينفثانون و نفثالين 8,5,4,1-رباعي حمض الكربوكسيل. كما يمكن إجراء سلسلة من تفاعلات الهلجنة،[10] والهدرجة والنترتة، بالإضافة إلى تفاعل ديلز-ألدر.[8]
الاستخدامات
عدليستخدم مركب البيرين ومشتقاته في تحضير الأصبغة. كما يستخدم كمركب معياري في مطيافية الفلورية.
المراجع
عدل- ^ ا ب ج PYRENE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Camerman, A.; Trotter, J. (10 Apr 1965). "The crystal and molecular structure of pyrene". Acta Crystallographica (بالإنجليزية). 18 (4): 636–643. DOI:10.1107/S0365110X65001494. ISSN:0365-110X. Archived from the original on 2024-05-02.
- ^ Senkan, Selim and Castaldi, Marco (2003) "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ^ Kucera، Benjamin E.؛ Jilek، Robert E.؛ Brennessel، William W.؛ Ellis، John E. (2014). "Bis(pyrene)metal complexes of vanadium, niobium and titanium: Isolable homoleptic pyrene complexes of transition metals". Acta Crystallographica Section C: Structural Chemistry. ج. 70 ع. 8: 749–753. DOI:10.1107/S2053229614015290. PMID:25093352.
- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 78، OCLC:4769982658، QID:Q126042864
- ^ منير البعلبكي؛ رمزي البعلبكي (2008). المورد الحديث: قاموس إنكليزي عربي (بالعربية والإنجليزية) (ط. 1). بيروت: دار العلم للملايين. ص. 123. ISBN:978-9953-63-541-5. OCLC:405515532. OL:50197876M. QID:Q112315598.
- ^ ا ب Senkan, Selim and Castaldi, Marco (2003) "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ^ Hoover، Rachel (21 فبراير 2014). "Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That". ناسا. مؤرشف من الأصل في 2017-03-21. اطلع عليه بتاريخ 2014-02-22.
- ^ Gumprecht, W. H. (1968) "3-Bromopyrene" Org. Synth., vol. 48, p. 30. دُوِي:10.15227/orgsyn.048.0030
- ^ Pham، Tuan Anh؛ Song، Fei؛ Nguyen، Manh-Thuong؛ Stöhr، Meike (2014). "Self-assembly of pyrene derivatives on Au(111): Substituent effects on intermolecular interactions". Chem. Commun. ج. 50 ع. 91: 14089. DOI:10.1039/C4CC02753A.