أكسيد الكالسيوم
مركب كيميائي
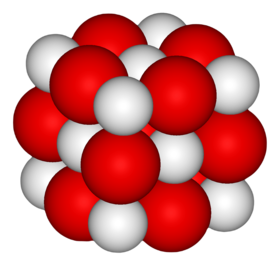
أكسيد الكالسيوم أو الجير الحي مركب كيميائي له الصيغة CaO ، ويكون على شكل مسحوق أبيض عديم الشكل البلوري (غير متبلور) في الحالة العادية، لكن ببلورته من مصهوره نحصل على بلورات مكعبية الشكل لها نمط بلورات كلوريد الصوديوم .
| أكسيد الكالسيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
أكسيد الكالسيوم |
|
| أسماء أخرى | |
الكلس الحي |
|
| المعرفات | |
| رقم CAS | 1305-78-8 |
| بوب كيم | 14778 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | CaO |
| الكتلة المولية | 56.08 غ/مول |
| المظهر | مسحوق أبيض |
| الكثافة | 3.37 غ/سم3 |
| نقطة الانصهار | 2572 °س |
| نقطة الغليان | 2850 °س |
| الذوبانية في الماء | يتفاعل |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الخواص
عدل- يتفاعل لدى تماسه مع الماء (تفاعل حلمهة) بشكل ناشر للحرارة مشكلاً هيدروكسيد الكالسيوم (الكلس المطفأ).
- CaO + H2O → Ca(OH)2
التحضير
عدليحضر أكسيد الكالسيوم صناعياً من تسخين كربونات الكالسيوم إلى حوالي 900°س (التفكك الحراري للحجر الجيري).
- CaCO3 → CaO + CO2
يمكن تحضير أكسيد الكالسيوم مخبرياً من أكسدة فلز الكالسيوم
- Ca + 1/2O2 → CaO
الاستخدامات
عدل- يستعمل في تحضير هيدروكسيد الكالسيوم المستخدم في مواد البناء.
- يستعمل كمادة قلوية في علم التعدين وفي صناعة الزجاج.
- نتيجة ارتفاع درجة انصهاره يستخدم أكسيد الكالسيوم لتبطين الأفران.
المصادر
عدل- ^ ا ب ج CALCIUM OXIDE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402